本试题 “科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主...” 主要考查您对氮气
焓变、反应热
化学反应进行的方向
盖斯定律
化学平衡常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氮气
- 焓变、反应热
- 化学反应进行的方向
- 盖斯定律
- 化学平衡常数
氮元素在自然界中的存在形式:
既有游离态又有化合态。空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素
氮气的物理性质和化学性质:
(1)物理性质:纯净的氮气是无色气体,密度比空气略小,氮气在水中的溶解度很小,在常压下101kPa,-195.8℃氮气变成无色液体,-209.9℃变成雪花状固体。氮气的分子结构:氮分子(N2)的电子式为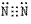 ,结构式为N≡N,由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
,结构式为N≡N,由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
(2)化学性质:氮分子化合价为0价,既可以升高也可以降低,说明氮气既有氧化性又有还原性。
①N2与H2化合生成NH3: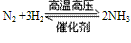
说明:该反应是一个可逆反应,是工业合成氨的原理。
②N2与金属反应(Mg Ca Sr Ba)反应: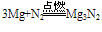
③N2与O2化合生成NO: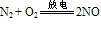
说明:在闪电或行驶的汽车引擎中会发生以上反应。
氮气的用途:
①合成氨,制硝酸;
②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;
⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;
④保存粮食、水果等食品,以防止腐烂;
⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;
⑥利用液氮制造低温环境,使某些超导材料获得超导性能。
反应热,焓变:
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学能可以转化为热能、电能和光能等,化学反应中的能量变化,通常主要表现为热量的变化。
1.定义:在化学反应过程中,当生成物和反应物具有相同温度时所放出或吸收的热量,通常叫做化学反应的反应热。在恒温、恒压条件下,化学反应过程中吸收或放出的热量称为反应的焓变。
2.符号:△Ⅳ
3.单位:kJ·mol-1
4.产生原因:化学反应过程中旧键断裂吸收的总能量与新键形成释放的总能量不相等,故化学反应均伴随着能量变化——吸热或放热。
5.表示方法:放热反应的△H<0,吸热反应的△H>0.
化学反应的方向与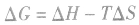 :
:
1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如 ,稳定性
,稳定性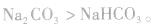
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如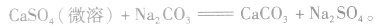
②由相对强酸(碱)向相对弱酸(碱)转变,如 ,
,  所以酸性强弱:
所以酸性强弱: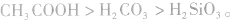
(3)由难挥发性物质向易挥发性物质转变
如 所以沸点:
所以沸点: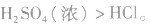
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如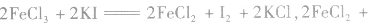
 ,则氧化性:
,则氧化性: 。
。
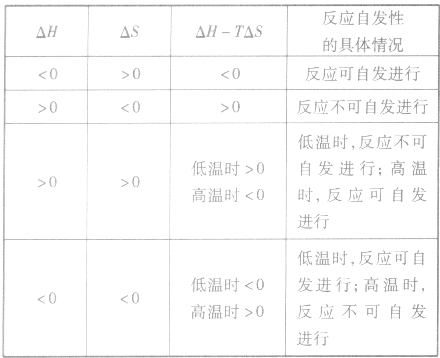
2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向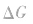
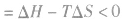 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;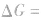
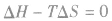 表明反应已达到平衡状态;
表明反应已达到平衡状态;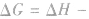
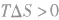 表明反应不能自发进行。
表明反应不能自发进行。
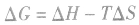 :
:1.化学反应进行方向的判据
(1)由稳定性弱的物质向稳定性强的物质转变
如
 ,稳定性
,稳定性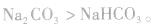
(2)离子反应总是向着使反应体系中某些离子浓度减小的方向进行
①溶解度大的物质向溶解度小的物质转变,如
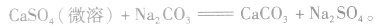
②由相对强酸(碱)向相对弱酸(碱)转变,如
 ,
,  所以酸性强弱:
所以酸性强弱: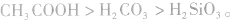
(3)由难挥发性物质向易挥发性物质转变
如
 所以沸点:
所以沸点: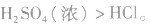
(4)由氧化性(还原性)强的物质向氧化性(还原性)弱的物质转变
如
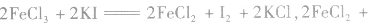
 ,则氧化性:
,则氧化性: 。
。 2.焓变和熵变共同判断反应的方向:
在温度、压强一定的条件下,自发反应总是向
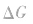
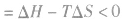 的方向进行,直至达到平衡状态;
的方向进行,直至达到平衡状态;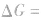
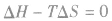 表明反应已达到平衡状态;
表明反应已达到平衡状态;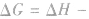
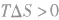 表明反应不能自发进行。
表明反应不能自发进行。
盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。

根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知


盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时

若按以下思路分析:

2.同一反应物状态不同时

3.两个有联系的不同反应相比

并且据此可写出下面的热化学方程式:


定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)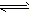 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: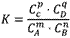
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
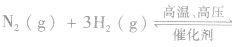


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: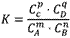
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
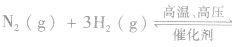


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
发现相似题
与“科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有...”考查相似的试题有:
- 下列关于热化学反应的描述中正确的是( )A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),...
- 下列说法错误的是[ ]A. NH4NO3溶于水虽然吸热,但其溶于水是自发过程B. 加热液体(温度高于沸点)会自发转变成气体,可用焓变...
- (1)环境专家认为可以用铝将水中的NO3-转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2...
- 在密闭容器中进行反应:H2(g)+Br2(g)2HBr(g) ΔH
- 将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应2A(g)+B(g)2C(g)若经 2 s(秒)后测得 ...
- 下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是:A.2NO2N2O4(正反应为放热反应)B.C(固)+CO22C...
- (13分)工业合成氨是硝酸工业中的重要步骤,已知N2(g) +3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1。请回答:(1) 当合成氨反应达到...
- “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正...
- 对于0.1mol/L CH3COOH溶液,下列叙述正确的是A.加入水时,平衡逆反应方向移动B.加入少量的NaOH固体,平衡向正反应方向移动C...
- 向一个体积可变的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s)3C(s)+4D(g)。在高温下达到平衡,测得混合气体...