本试题 “能证明Na2SO3溶液中存在SO32-+H2O⇌HSO3-+OH-水解平衡的事实是( )A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去B.滴入酚酞溶液变红,再加入氯水后红色退...” 主要考查您对盐类水解的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 盐类水解的定义
盐类水解:
1.定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类水解。
2.实质:生成弱电解质,使水的电离平衡被破坏而建立新的平衡。
3.条件:盐中必须有弱酸根离子或弱碱阳离子,盐溶于水。
4.特点:可逆性,写水解离子方程式时要用“ ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
5.规律:有弱才水解,无弱不水解。谁弱谁水解,谁强显谁性。越弱越水解,都弱都水解。例如:25℃时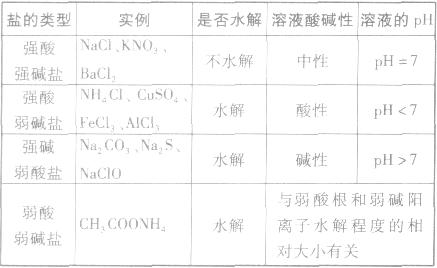
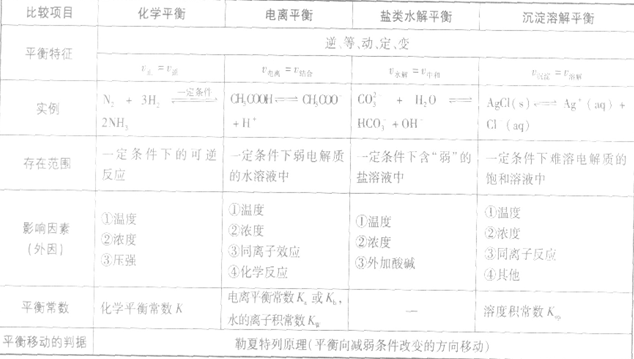
四种重要的动态平衡的比较:
发现相似题
与“能证明Na2SO3溶液中存在SO32-+H2O⇌HSO3-+OH-水解平衡的事实是...”考查相似的试题有:
- 相同温度、相同物质量浓度的四种溶液:①CH3COONa、②NaHSO4、③NaCl、④Na2CO3按pH值由大到小的顺序排列,正确的是A.④>①>③>②B....
- 下列叙述中正确的是A.体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m10V(甲)C.2...
- 下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )①在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)...
- 对滴有酚酞试液的下列溶液,操作后颜色变深的是( )A.明矾溶液加热B.CH3COONa溶液加热C.氨水中加入少量NH4Cl固体D.NaHCO...
- 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说...
- 下列变化不属于盐类水解反应的是( )①NH3+H2ONH4++OH- ②HCO3-+ H2OH2CO3+OH-③HCO3-+H2OH3O++CO32- ④A13++3HCO3-=Al(OH)...
- 酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:回...
- 下列电解质溶液的有关叙述正确的是( )A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7B.在含有BaSO4沉淀的溶液中加入N...
- 下列溶液中微粒浓度关系一定正确的是
- 下列说法正确的是A.明矾用于净水与Al3+的水解有关B.配制FeCl3溶液时,为了抑制Fe3+的水解,常加入少量稀硫酸C.船舶外壳镶...