本试题 “加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质...” 主要考查您对物质的分离
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的分离
分离与提纯的原则和要求:
(1)选择分离与提纯方法应遵循的原则
①不增:指不能引入新的杂质。
②不减:指应尽可能减少被分离与提纯的物质的损失。
③易分离:指如果使用试剂除去杂质时,要求反应后的产物跟被提纯的物质容易分离。
④易复原:指分离物或被提纯的物质都要容易复原。
(2)分离与提纯操作过程应遵循“三必须”
①除杂质试剂必须过量;
②过量试剂必须除尽(因过量试剂会带人新的杂质);
③除杂途径必须选最佳。
常见的分离与提纯的方法:
(1)物质分离与提纯常用的物理方法
| 方法 | 适用范围或原理 | 装置 | 举例 | 注意事项 |
| 过滤 | 分离固体和液体混合物 | 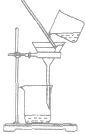 |
粗盐提纯时把粗盐溶于水,经过滤把不溶于水的杂质除去 | ①要“一贴二低三靠” 滤纸紧贴漏斗内壁;滤纸边缘低于漏斗口,漏斗里液面低于滤纸边缘;烧杯口紧靠玻璃棒,玻璃捧下端紧靠三层滤纸.漏斗下端紧靠烧杯内壁。 ②必要时洗涤沉淀物(在过滤器中加少量水),不可搅拌 |
| 结晶 重结晶 |
分离各组分在溶剂中的溶解度随温度变化不同的混合物 | 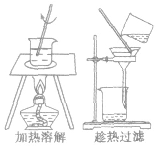 |
KNO3溶解度随温度变化大, NaCl溶解度随温度变化小,可用该法从二者的混合液中提纯KNO3 | ①一般先配较高温度下的浓溶液,然后降温结晶 ②结晶后过滤,分离出晶体 |
| 蒸发 | 溶解度随温度变化较小的物质 |  |
从食盐水溶液中提取食盐晶体 | ①溶质应不易分解、不易水解、不易被氧气氧化 ②蒸发过程应不断搅拌 ③近干时停止加热,余热蒸干 |
| 蒸馏 | 分离沸点不同的液体混合物 | 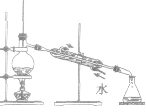 |
制无水乙醇(加生石灰)、硝酸的浓缩[加浓硫酸或 Mg(NO3)2] | ①温度计水银球在蒸馏烧瓶支管口处 ②加沸石(碎瓷片) ③注意冷凝管水流方向应下进上出 ④不可蒸干 |
| 分馏 | 分离多种液态混合物 | 同蒸馏 | 石油分馏 | 同蒸馏 |
| 萃取 | 分离两种互溶的液体 |  |
CCl4把溴水中的Br2萃取出来 |
①萃取后再进行分液操作 ②对萃取剂的要求:与原溶剂互不混溶,不反应;溶质在其中的溶解度比在原溶剂中大;溶质不与萃取剂反应 ③萃取后得到的仍是溶液,一般要通过分馏等方法进一步分离 |
| 分液 | 分离两种不相混溶的液体(密度不同) | 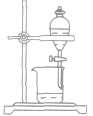 |
水、苯的分离 | 下层液体从下口放出,上层液体从上口倒出 |
| 液化 | 利用气体混合物中某组分易液化的特点来分离 | 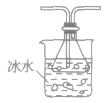 |
除去SO2中的SO3 | 可把锥形瓶换成硬质大试管 |
| 盐析 | 利用某些物质在加某些无机盐时,其溶解度降低而凝聚的性质来分离物质 | —— | 从皂化液中分离肥皂、甘油,蛋白质的盐析 | 盐析是物理变化。盐析之后一般要采取过滤的操作 |
| 洗气 | 杂质气体易溶于某液体 | 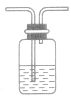 |
除去CO2中的HCl气体,可使混合气体通过盛有饱和NaHCO3 溶液的洗气瓶 | ①从洗气瓶的长导管一端进气 ②混合物中气体溶解度差别较大 |
| 升华 | 利用某些物质有升华的特性 |  |
粗碘中碘与钾、钠、钙、镁的碘化物混合,利用碘易升华的特点将碘与杂质分开 | 升华物质的集取方法不作要求 |
| 渗析 | 胶体提纯、精制 | 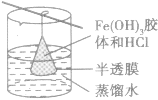 |
除去Fe(OH)3胶体中的HCl | 要不断更换烧杯中的水或改用流动水,以提高渗析效果 |
(2)物质分离与提纯常用的化学方法:
①加热法
混合物中混有某些热稳定性差的物质时,可直接加热,使热稳定性差的物质分解而分离出来。例如:食盐中混有氯化铵、纯碱中混有小苏打等均可直接加热除去杂质。
②沉淀法
在混合物中加入某试剂,使其中一种以沉淀形式分离出去的方法。使用该方法一定要注意不能引入新杂质,若使用多种试剂将溶液中不同粒子逐步沉淀时,应注意后加入试剂能将先加入的过量试剂除去,最后加入的试剂不引入新杂质。例如:加入适量BaCl2溶液可除去NaCl中混有的Na2SO4。
③转化法
利用化学反应将某种物质进行多次转化而分离。例如:分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3和NaAlO2,过滤后,分别再加盐酸重新生成Fe3+和Al3+。注意转化过程中尽量减少被分离物质的损失.而且转化后的物质要易恢复为原物质。
④酸碱法
被提纯物质不与酸或碱反应,而杂质可与酸或碱发生反应,可用酸或碱作除杂试剂。例如:用盐酸除去 SiO2中的石灰石,用氢氧化钠除去铁粉中的铝粉。
⑤氧化还原法
a.对混合物中混有的还原性杂质,可加入适当的氧化剂将杂质氧化为被提纯物质。例如:将氯水滴入混有FeCl2的FeCl3溶液中,除去FeCl2杂质。
b.对混合物中混有的氧化性杂质,可加入适当还原剂将杂质还原为被提纯物质。例如:将过量铁粉加入混有FeCl3的FeCl2溶液中,振荡过滤,除去FeCl3 杂质。
⑥调节pH法
通过加入试剂来调节溶液的pH,使溶液中某组分沉淀而分离的方法。一般加入相应的难溶或微溶物来调节。例如:在CaCl2溶液中含有FeCl3杂质,由于 Fe3+水解,溶液呈酸性,可采用调节溶液pH的方法将 Fe3+沉淀除去,为此,可向溶液中加氧化钙或氢氧化钙或碳酸钙等。
⑦电解法
此法利用电解原理来分离、提纯物质。例如:电解精炼铜,将粗铜作阳极,精铜作阴极,电解液为含铜离子的溶液,通直流电,在阳极铜及比铜活泼的杂质金属失电子,在阴极只有铜离子得电子析出,从而提纯了铜。
发现相似题
与“加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,...”考查相似的试题有:
- 只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开,该试剂是( ) A.BaCl2溶液 B.FeCl2溶液C.FeCl3溶液 D...
- 根据下列实验内得出的结论正确的是选项实验内容结论A.一红棕色气体能使湿润的KI–淀粉试纸变蓝证明该红棕色气体一定为溴蒸气B...
- 下列有关物质分离提纯方法的说法中正确的是( )①过滤--适用于不溶性固体和液体的分离②蒸馏--适用于互溶性且沸点相差较大的液...
- 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:(1)实验室进行过滤操作的常用玻璃仪器有 。(2)...
- 某化学兴趣小组同学在馓“证明海带中存在碘元素”的实验时,对课本上的描述:“海带灼烧后的灰烬中碘元素以I-形式存在”产生了疑...
- 下列实验装置或操作能达到实验目的
- (4分)为了检验和除去下表中的各种杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(II)中选出适当的除杂试剂,...
- 下列的分离方法不正确的是( )A.用酒精萃取碘水中的碘B.用过滤的方法除去食盐水中的泥沙C.用蒸馏的方法将自来水制成蒸馏...
- 用括号中的试剂除去各组物质中的少量杂质正确的是A.苯中的甲苯(溴水)B.乙酸乙酯中的乙酸(NaOH溶液)C.乙醇中的乙酸(NaOH溶...
- 选择下列实验方法分离物质,将分离方法的序号填在横线上。A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.层析 G.过滤(1...