本试题 “下表中物质的分类组合,完全正确的是[ ]强电解质 弱电解质非电解质A.KNO3NH3·H2O SO2B.H2SO4CaCO3AlC.BaSO4 HClO H2OD.HClO4 C2H5OHCH3COOH” 主要考查您对强电解质、弱电解质
电解质、非电解质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 强电解质、弱电解质
- 电解质、非电解质
强电解质:
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“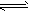 ”表示。
”表示。
在水溶液里或熔融状态下,能全部电离的化合物。包括:强酸、强碱、大多数盐、活泼金属氧化物等;完全电离、不可逆、不存在电离平衡;电离方程式用“=”表示。
弱电解质:
在水溶液里或熔融状态下,不能全部电离的化合物。包括:弱酸、弱碱、少数盐等;部分电离、可逆、存在电离平衡,电离方程式用“
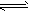 ”表示。
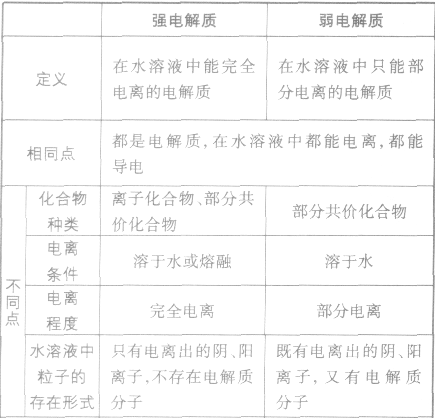
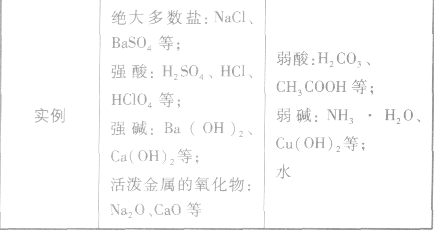
”表示。 强电解质和弱电解质的比较:
强弱电解质的判断依据:
1.在相同浓度、相同温度下,与强电解质做导电性对比实验.
2.浓度与pH的关系。如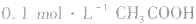 溶液的pH>1,则证明
溶液的pH>1,则证明 是弱电解质。
是弱电解质。
3.测定对应盐溶液的酸碱性。如 溶液呈碱性,则证明醋酸是弱电解质。
溶液呈碱性,则证明醋酸是弱电解质。
4.稀释前后的pH变化与稀释倍数的关系。例如,将pH=2的酸溶液稀释1000倍,若pH<5,则证明该酸为弱电解质;若pH=5,则证明该酸为强电解质。
5.采用实验证明电离平衡。如向醋酸溶液中滴人石蕊试液,溶液变红,再加入醋酸钠晶体,颜色变浅。
电解质和非电解质:
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
发现相似题
与“下表中物质的分类组合,完全正确的是[ ]强电解质 弱电解质非...”考查相似的试题有:
- 下列电离方程式中,书写错误的是A.Ba(OH)2= Ba2++ 2 OH-B.H3PO43 H++ PO43-C.HClOH++ ClO-D.NH3·H2ONH4++ OH-
- 有以下几种物质①NaCl(l) ②HCl(l) ③水银 ④蔗糖 ⑤液态醋酸⑥KNO3溶液 ⑦氯气⑧液态SO3⑨纯水⑩熔融KOH,填空回答(填序号):以...
- 下列物质中,属于强电解质的是( ),属于弱电解质的是( ),属于非电解质的是( )。A碘化钾;B乙醇;C氨气;D蔗糖;E氢硫...
- 下列电离方程式,书写正确的是A.KMnO4=K++Mn7++4O2-B.NaHCO3=Na++H++CO32-C.AlCl3=Al3++Cl3-D.Al2(SO4)3=2Al3++3SO42-
- 下列说法正确的是( )A.BaSO4不溶于水,所以BaSO4不是电解质B.液态HCl不能导电,但它是电解质C.CO2溶于水能够导电,所以...
- 现有以下物质:①NaCl晶体 ②液态SO3③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔化K2SO4⑨纯水.请回答...
- 下列说法正确的是( )A.碳酸钙不溶于水,所以碳酸钙是非电解质B.二氧化碳溶于水可以导电,所以二氧化碳是电解质C.氯化钠...
- 下列关于电解质的说法正确的是( )A.氯化氢气体不能导电,所以氯化氢不是电解质B.SO2溶于水形成的溶液能导电,所以SO2是电...
- NaHCO3和NaHSO4的稀溶液混合,实际参加反应的离子是A.H+和CO32―B.HCO3―和HSO4―C.HCO3―和SO42―D.HCO3―和H+
- (1)下列4组物质均有一种物质的类别与其它三种不同A.CaO、Na2O、CO2、CuO B.H2、C、P、CuC.O2、Fe、Cu、Zn D.HCl、H2O、...