本试题 “在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:时间(s)020406080n(NO2)/mol0....” 主要考查您对化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡的有关计算
化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
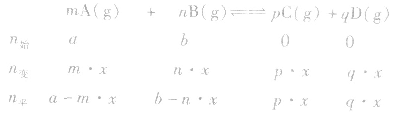
则有:

(2)对于反应物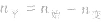 ,对于生成物
,对于生成物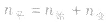
(3)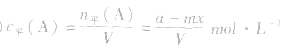
(4)A的转化率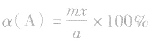
(5)平衡时A的体积(物质的量)分数
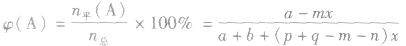
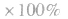
(6)
(7)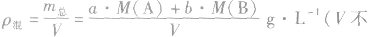
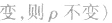
(8)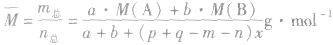
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
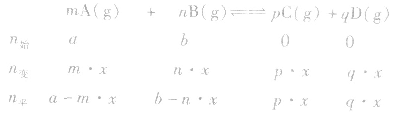
则有:

(2)对于反应物
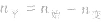 ,对于生成物
,对于生成物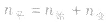
(3)
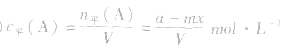
(4)A的转化率
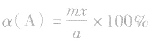
(5)平衡时A的体积(物质的量)分数
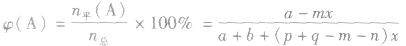
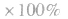
(6)

(7)
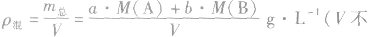
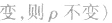
(8)
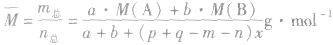
发现相似题
与“在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中...”考查相似的试题有:
- 反应 aA(气)+ bB气)cC(气)有如下性质:V正=K1[A]a·[B]b、V逆=K2[C]c、K1,K2温度不变时分别为一常数,在其他条件不变时...
- 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),平衡时体系中c(Pb...
- (8分)某工厂实验室用CO和H2制备CH3OH,其原理为:CO(g)+2H2(g) CH3OH(g) △H < 0试回答下列问题:(1)若该反应在298K、398K...
- 某固定体积的密闭容器中存在从A开始反应的化学平衡:aA(g)bB(g) + cC(g),在温度不变的条件下,再充入一定量的A物质,重新达...
- 在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:物质XYZ初始浓度/(mol·L-1)0.10.20平衡浓度/(mol·L-1)0.050....
- 可逆反应A(g)+nB(g)2C(g)(正反应为放热反应),在一定温度下,反应物B的转化率与压强有如图所示的关系,那么n值一定是…( )A.n...
- 在密闭容器中的一定量混合气体发生反应xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol/L.保持温度不变,将容器的容积...
- (16分)Ⅰ.在一定条件下,xA+yBzC,达到平衡,试填写下列空白:(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则...
- 在一密闭容器中有如下反应:L(s)+aG(g)bR(g)温度和压强对该反应的影响如图所示,其中压强p1bC.G的转化率随温度升高而...
- 开发新能源和三废处理都是可持续发展的重要方面。(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料...