本试题 “实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空:(1)圆底烧瓶中加入的反应物是溴化钠、___________和1:1的硫酸。配制体积比1:1的硫酸所用的...” 主要考查您对卤代烃
其他物质的制备(硫酸铜晶体、铁红等)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 卤代烃
- 其他物质的制备(硫酸铜晶体、铁红等)
卤代烃:
1.卤代烃的定义
烃分子中的氢原子被卤素原于取代后生成的化合物,称为卤代烃,可用R—X(X为卤素原子)表示。在卤代烃分子中,卤素原子是官能团。由于卤素原子吸引电子的能力较强,使共用电子对偏移,c—x键具有较强的极性,因此卤代烃的反应活性增强。
2.卤代烃的分类 (1)根据分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃和碘代烃。
(2)根据分子中所含卤素原子个数的不同,分为一卤代烃和多卤代烃。
(3)根据烃基结构不同,分为卤代烷烃、卤代烯烃、卤代芳香烃等。
卤代烃的性质:
1.卤代烃的物理性质
(1)常温下,卤代烃中除一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余为液体或固体。
(2)一氯代烷的物理性质:随着碳原子数增加,其熔、沸点和密度逐渐增大(沸点和熔点大于相应的烃)。
(3)难溶于水,易溶于有机溶剂,除脂肪烃的一氟代物、一氯代物等部分卤代烃外,液态卤代烃的密度一般比水大。密度一般随烃基中碳原子数增加而增大。
2.卤代烃的化学性质与C2H5Br相似,可以发生水解反应和消去反应
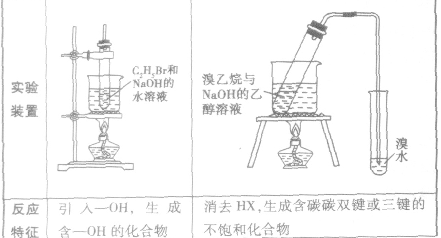

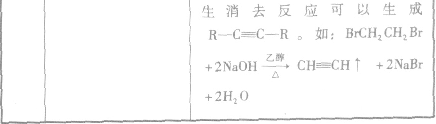
卤代烃中卤素的检验:
1.实验原理
根据AgX的颜色(白色、淡黄色、黄色)可确定卤素(氯、溴、碘):
2.实验步骤
①取少量卤代烃;
②加入NaOH溶液;
③加热煮沸;
④加入过量稀硝酸酸化;
⑤加入AgNO3溶液。
3.实验说明加热煮沸是为了加快水解速率,因不同的卤代烃水解难易程度不同;加入过量稀硝酸酸化是为了中和过量的NaOH,防止NaOH与AgNO3反应,干扰实验现象,同时也是为了检验生成的沉淀是否溶于稀硝酸。
卤代烃在有机物转化和合成中的重要桥梁作用:
1.一元代物与二元代物之间的转化关系 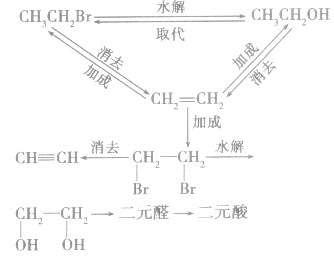
2.卤代烃的桥梁作用通过烷烃、芳香烃与X2发生取代反应,烯烃、炔烃与X2、HX发生加成反应等途径可向有机物分子中引入一X;而卤代烃的水解和消去反应均消去一X。卤代烃发生取代、消去反应后,可在更大的空间上与醇、醛、酯相联系。引入卤素原子常常是改变性能的第一步,卤代烃在有机物转化、推断、合成巾具有“桥梁”的重要地位和作用。
溴乙烷:
1.分子结构
分子式: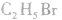
结构式: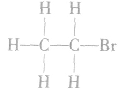
电子式: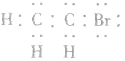
结构简式: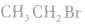
2.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点为38.4℃,密度比水大,难溶于水,易溶于乙醇等多种有机溶剂。
3.溴乙烷的化学性质
(1)水解反应:溴乙烷在NaOH存在的条件下可以跟水发生反应生成乙醇和溴化氢。 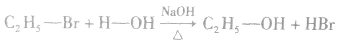
说明:溴乙烷的水解反应又属于取代反应。
溴乙烷水解生成的HBr与NaOH易发生中和反应,水解方程式也可写为:

(2)消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX)而生成含不饱和键(双键或三键)化合物的反应,叫做消去反应。
溴乙烷与强碱(NaOH或KOH)的乙醇溶液共热,从溴乙烷分子中脱去HBr,生成乙烯: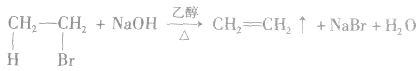
(1)反应原理:CH3COONa+NaOH
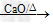 CH4+Na2CO3
CH4+Na2CO3(2)发生装置:固+固
 气
气 (3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H2O和CO2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO2+H2O==2HNO3+NO;NO+NO2+2NaOH===2NaNO2+H2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H2SO4
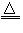 Na2SO4+2HCl?
Na2SO4+2HCl?(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
五水硫酸铜的制备:
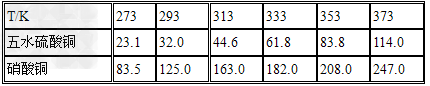
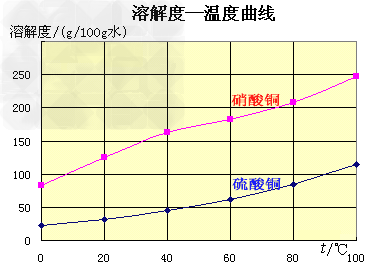
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4====CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H2S↑+FeCl2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO4溶液或碱液吸收(H2S+2NaOH==Na2S+H2O或H2S+NaOH==NaHS+H2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑
与“实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填...”考查相似的试题有:
- 下列关于卤代烃的叙述正确的是[ ]A.所有卤代烃都是难溶于水,比水重的液体B.所有卤代烃在适当条件下都能发生消去反应C.所...
- 常温常压下为无色液体,而且密度大于水的是 ①苯②硝基苯③溴苯④溴乙烷⑤正己烷⑥四氯化碳⑦CH3Cl⑧丁烯⑨甲苯A.②③④⑥B.②③④⑥⑨C.①②③④...
- (15分).有机物A 是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂。(1)有机物A能够发生的反应有: (填写字母)a...
- 写出化学反应方程式(1)苯酚钠溶液中通入CO2______(2)溴乙烷和氢氧化钠溶液共热______(3)乙酸与乙醇发生酯化反应______.
- 美国科学家设想“绿化”火星并使其成为第二个地球:火星上造超级温室气体.美国宇航局(NASA)马里诺娃博士找到了一种比二氧化...
- 某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图所示。关于“亮菌甲素”的说法中,正确的是A.“亮菌甲素”可以与乙酸发生...
- 1 mL密度为0.93 g·cm―3的氨水恰好中和0.005mol H2SO4生成(NH4)2SO4,若要配制上述浓度的氨水,在1L水中需要溶解标准状况下的...
- 过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下...
- 对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。一种...
- 某课外活动兴趣小组欲用下列化学试剂在实验室里制取Cl2并验证Cl2的某些化学性质。实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH...