本试题 “用下列常见的气体物质进行填空(每空只需填一个序号):①O2②N2③CO ④CH4⑤SO2(1)污染空气形成酸雨的是_______(2)吸烟时产生的一种易与血液中血红蛋白结合的有毒气...” 主要考查您对酸雨
氧气的用途
化石燃料
氮气的性质和用途
一氧化碳的性质和用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸雨
- 氧气的用途
- 化石燃料
- 氮气的性质和用途
- 一氧化碳的性质和用途
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2
 SO2
SO2 二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2
 2NO
2NO 一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
知识拓展:
1. 酸雨区
某地收集到酸雨样品,还不能算是酸雨区,因为一年可有数十场雨,某场雨可能是酸雨,某场雨可能不是酸雨,所以要看年均值。目前我国定义酸雨区的科学标准尚在讨论之中,但一般认为:年均降水pH高于5.65,酸雨率是0-20%,为非酸雨区;pH在5.30--5.60之间,酸雨率是10--40%,为轻酸雨区;pH在5.00--5.30之间,酸雨率是30-60%,为中度酸雨区;pH在4.70--5.00之间,酸雨率是50-80%,为较重酸雨区;pH小于4.70,酸雨率是70-100%,为重酸雨区。这就是所谓的五级标准。其实,北京、拉萨、西宁、兰州和乌鲁木齐等市也收集到几场酸雨,但年均pH和酸雨率都在非酸雨区标准内,故为非酸雨区。
2. 我国三大酸雨区
我国酸雨主要是硫酸型
我国三大酸雨区分别为:
(1)西南酸雨区:是仅次于华中酸雨区的降水污染严重区域。
(2)华中酸雨区:目前它已成为全国酸雨污染范围最大,中心强度最高的酸雨污染区。
(3)华东沿海酸雨区:它的污染强度低于华中、西南酸雨区。
用途作用:
1. 冶炼工艺 在炼钢过程中吹以高纯度氧气,氧便和碳及磷、硫、硅等起氧化反应,这不但降低了钢的含碳量,还有利于清除磷、硫、硅等杂质。而且氧化过程中产生的热量足以维持炼钢过程所需的温度,因此,吹氧不但缩短了冶炼时间,同时提高了钢的质量。高炉炼铁时,提高鼓风中的氧浓度可以降焦比,提高产量。在有色金属冶炼中,采用富氧也可以缩短冶炼时间提高产量。
2. 化学工业
在生产合成氨时,氧气主要用于原料气的氧化,以强化工艺过程,提高化肥产量。再例如,重油的高温裂化,以及煤粉的气化等。
3. 国防工业
液氧是现代火箭最好的助燃剂,在超音速飞机中也需要液氧作氧化剂,可燃物质浸渍液氧后具有强烈的爆炸性,可制作液氧炸药。
4. 医疗保健
供给呼吸:用于缺氧、低氧或无氧环境,例如:潜水作业、登山运动、高空飞行、宇宙航行、医疗抢救等时。
5. 其它方面
如:它本身作为助燃剂与乙炔、丙烷等可燃气体配合使用,达到焊割金属的作用,各行各业中,特别是机械企业里用途很广,作为切割之用也很方便,是首选的一种切割方法。
过度吸氧负作用:
早在19世纪中叶,英国科学家保尔·伯特首先发现,如果让动物呼吸纯氧会引起中毒,人类也同样。氧气瓶氧气瓶人如果在大于0.05MPa(半个大气压)的纯氧环境中,对所有的细胞都有毒害作用,吸入时间过长,就可能发生“氧中毒”。肺部毛细管屏障被破坏,导致肺水肿、肺淤血和出血,严重影响呼吸功能,进而使各脏器缺氧而发生损害。在0.1MPa(1个大气压)的纯氧环境中,人只能存活24小时,就会发生肺炎,最终导致呼吸衰竭、窒息而死。人在0.2MPa(2个大气压)高压纯氧环境中,最多可停留1.5小时~2小时,超过了会引起脑中毒,生命节奏紊乱,精神错乱,记忆丧失。如加入0.3MPa(3个大气压)甚至更高的氧,人会在数分钟内发生脑细胞变性坏死,抽搐昏迷,导致死亡。
此外,过量吸氧还会促进生命衰老。进入人体的氧与细胞中的氧化酶发生反应,可生成过氧化氢,进而变成脂褐素。这种脂褐素是加速细胞衰老的有害物质,它堆积在心肌,使心肌细胞老化,心功能减退;堆积在血管壁上,造成血管老化和硬化;堆积在肝脏,削弱肝功能;堆积在大脑,引起智力下降,记忆力衰退,人变得痴呆;堆积在皮肤上,形成老年斑。
缺氧和富氧对人体的影响:
氧气浓度(%体积)---征兆(大气压力下)
100%---致命/6分钟;
50%---致命/4-5分钟经治疗可痊愈
>23.5%---富氧,有强烈爆炸危险
20.9%---氧气浓度正常
19.5%---氧气最小允许浓度
15-19%---降低工作效率,并可导致头部、肺部和循环系统问题
10-12%---呼吸急促,判断力丧失,嘴唇发紫
8-10%---智力丧失,昏厥,无意识,脸色苍白,嘴唇发紫,恶心呕吐
6-8%---8分钟;
4-6%---40秒内抽搐,呼吸停止,死亡
化石燃料是由古代动植物的遗骸经过一系列复杂变化而形成的。化石燃料包括煤(工业的粮食),石油(工业的血液)和天然气,是不可再生能源。
煤:
①煤是固体燃料,其最大的缺点是燃烧速率慢,利朋效率低,且不适用于多数运输业作动力源,还会导致严重的大气污染。从资源、经济与环境三方面综合考虑,适宜在煤产地搞热电联产,提高煤炭转换成电能的比重.住城市发展煤气或液化燃料。煤的综合利用煤是我国主要的化石能源,占90%以上,煤的综合利用措施主要有下列三条:
a.煤的气化:目前主要是煤在高温下与水蒸气的反应。产物为燃料气,又可作化工原料。主要产品有CO、CH4、H2等。
b.煤的焦化:也称煤的干馏,是在隔绝空气的条件下加强热.使组成煤的物质发生分解反应。主要产品及用途:焦炭:金属冶炼;煤焦油:重要的化工原料;焦炉气:含有CO、CH4、H2等,既可作燃料又是重要的化工原料。
c. 煤的液化:煤发生化学反应,分裂为小分子,利用催化剂向小分子中加入氯元素.得到与石油产品成分相近的燃料油,是一项人造石油的技术。
②煤气:
a.煤气的形成:煤气作为一种生活燃料,在一些城市被使用.煤气通常情况下是利用煤与水蒸气在高温条件反应生成的:C+H2O
 CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体
CO+H:煤气的主要成分是CO,但同时含有H2、CH4等其他可燃性气体 b.煤气中报警物质的特性:由于煤气的主要成分CO是一种无色、无味的有毒气体,当煤气泄漏时不易察觉,会危害人体健康甚至危及生命。为了安全起见,通常在煤气中加入一些持殊的物质,如乙硫醇(C2H5SH)。乙硫醇具有特殊刺激性气味,当煤气泄漏时,可以使人很快警觉,并马上采取措施,防止发生爆炸、火灾和中毒事故;同时,乙硫醇在煤气燃烧过称中可以充分燃烧不仪煤气.其他可燃性气体如天然气、液化石油气中通常也加入少量报警物质。
石油的综合利用:
①石油是由多种物质组成的混合物,没有同定的组成和性质,根据组成石油的各组分的沸点不同,可从石油中分离出不同的燃料,如汽油、煤油、液化石油气等,
②石油分馏产品及用途
溶剂油——溶剂
汽油—一汽车燃料
航空煤油一一飞机燃料
柴油一—拖拉机、轮船燃料
润滑油一一润滑剂
石蜡——蜡烛
沥青——筑路
石油不仅是优质的能量来源,还是宝贵的化工资源。使石油中的大分子断裂为小分子.小分子重新组合成大分子,从而把石油转化为工农业、医疗、化工等产品,因此把石油称怍“工业的血液”。石油化学工业不同于石油分离,石油化学工业是石油发生复杂的反应,从而生成各种产品,是化学变化。
天然气:
天然气的主要成分是甲烷,主要含碳、氢两种元素。天然气里的甲烷是在隔绝空气的情况下,主要由植物残体分解而生成的。有石油的地方,一般就有天然气。天然气是一种重要的气体燃料。但其贮藏量是有限的。
①甲烷的组成
甲烷是由碳、氢两种元素组成的化合物,其化学式为CH4,是一种最简单的有机物,其中含氢元素的质量分数为25%,是氢元素含量最高的有机物。
②甲烷的性质
a. 物理性质:无色,无味的气体,极难溶于水,它的密度比空气小。
b. 化学性质——可燃性
纯净的甲烷在空气中能安静地燃烧在火焰上方罩一冷而干燥的小烧杯,然后再换一个内壁有石灰水的小烧杯。
现象:烧杯内壁有水珠生成,烧杯内壁的石灰水变浑浊。
结论:甲烷中含有碳元素和氢元素,是由碳和氢两种元素组成的化合物,化学式为CH4。
化学方程式:CH4+O2
 CO2+H2O
CO2+H2Oc. 当甲烷与氧气或空气混合后,点燃就有发生爆炸的危险(按体积计算爆炸极限为5%—15%),所以在煤矿的矿井里必须采取通风,严禁烟火等安全措施,以防甲烷和空气等混合发生爆炸。
煤,石油,天然气的区别
| 煤 | 石油 | 天然气 | |
| 形成 | 古代植物被埋在地下经过一系列复杂变化而形成 | 古代植物遗骸在地壳中经过复杂变化而形成 | |
| 元素组成 | 主要含C;少量含:H、N、S、O等 | 主要含C、H,少量含S、N、O | 主要含C、H,主要成分是CH4 |
| 类别 | 混合物(由有机物和无机物组成) | 混合物(多种有机物) | 混合物 |
| 形态 | 黑色固体,有光泽,人称“黑色金子”,无固定的熔点,沸点,具有可燃性 | 粘稠液体,黑色或棕色,不溶于水,密度比水小,无固定的熔点,沸点 | 无色无味气体,密度比空气小,极难溶于水 |
| 性质 | 煤 焦炭,煤焦油、煤气等 焦炭,煤焦油、煤气等 |
石油 溶剂油,汽油,航空煤油,煤油,柴油等 溶剂油,汽油,航空煤油,煤油,柴油等 |
易燃烧,产生明亮的蓝色火焰,化学方程式为CH4+2O2 CO2+2H2O CO2+2H2O |
化石燃料燃烧与环境的关系:
①化石燃料燃烧产生的物质
化石燃料煤、石油和天然气都是含碳元素的物质.其中还含硫元素等杂质。这些燃料燃烧时,会产生二氧化硫等污染空气的气体,燃料燃烧不充分,会产生一氧化碳和碳粒,加上未燃烧的碳氢化合物,如果直接排放到空气中必然对空气造成污染化石燃料燃烧时排放出的物质有:
a.一氧化碳:
b.碳氢化合物;
c.碳粒和尘粒;
d.二氧化碳
②煤燃烧产生的有害物质
由于煤所含元素有C、H、N、S、O等几种,所以煤燃烧时会排放出二氧化硫、氮的氧化物等.这些气体溶于水会形成酸雨,酸雨会对森林、雕像、建筑物等造成腐蚀。当煤未充分燃烧时,会产生一氧化碳,一氧化碳是夺气的污染物。煤在燃烧时,会散出固体小颗粒(未燃烧的碳粒),造成对空气的粉尘污染。家庭里用煤炉烧煤时,常常会闻到一股激性气味,并看到炉口上方蓝色火焰、这种刺激气昧是烧煤时产生的二氧化硫的气味,蓝色火焰主要是生成的一氧化碳燃烧而产生的。二氧化碳的大量排放,超过自然界的消耗能力,就会引起温室效应,会使大气变暖,陆地减少。
③减少煤燃烧污染的措施
a.燃烧低硫优质煤,或是采用燃料脱硫技术.减少SO2的排放;
b.尽量使燃料完全燃烧;
c.减少化石燃料的使用,开发新能源:
d.植树造林;
e.变分散供热为集中供热。
④汽车用燃料燃烧对空气的影响及减少空气污染的措施
| 燃料燃烧对空气的影响 | 减少空气污染的措施 | |
| 汽车用燃料的燃烧 | 汽车使用的燃料 (汽油或柴油)燃烧产生的尾气中,主要污染物有一氧化碳、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘等 | ①改进发动机的燃烧方式,使汽油或柴油充分燃烧;②使用催化净化装置,使有害气体转化为无害物质;④使用无铅汽油。禁止含铅物喷排放,同时在管理上加入检测尾气的力度等 |
化石燃料的使用与开发:
现有的化石燃料是有限的,而且是不可再生的,每种化石燃料都确有用尽的时候。下表是我同1998年探明的化石燃料储量及产量和使用年限
| 探明储量 | 年产量 | 使用年限 | |
| 石油 | 32.7亿吨 | 1.6亿 | 约20年 |
| 天然气 | 1.37×104亿立方米 | 217亿立方米 | 约63年 |
| 煤 | 1145亿吨 | 12.4亿 | 约92年 |
节约能源,充分利用能源,使燃料充分燃烧,可从以下两个方面着手:
①燃烧时要有足够的空气;
②燃料与空气要有足够大的接触面积,充足的空气才能使燃料尽可能完全燃烧,与空气充分接触才能使其反应快,对能量的利用损失小,
氮气,常况下是一种无色无味无臭的气体,且通常无毒。氮气占大气总量的78.12%(体积分数),是空气的主要成份。常温下为气体,在标准大气压下,冷却至-195.8℃时,变成没有颜色的液体,冷却至-209.86℃时,液态氮变成雪状的固体。氮气的化学性质很稳定,常温下很难跟其他物质发生反应,但在高温、高能量条件下可与某些物质发生化学变化,用来制取对人类有用的新物质。
物理性质:
(1)无色无味的气体
(2)不易溶于水
(3)在标准状况下密度为1.251g/L,密度比空气略小
化学性质:
化学性质不活泼,一般情况下不能燃烧,也不支持燃烧;在常温下难与其他物质发生反应,但在高温下也能与一些物质发生化学反应。
用途:
(1)焊接金属时做保护气
(2)灯泡中填充氮气以延长灯泡的使用寿命,食品包装袋中充有氮气以防止食品腐烂变质
(3)医疗上可以在液氮冷冻麻醉的条件下做手术
(4)超导材料在液氮的低温环境下能显示超导性能
(5)制造氮肥和硝酸
(6)有些博物馆把贵重罕见的书画,墨宝保存在充满氮气的圆筒中,既可以避免氧化变质,又可防止虫蛀霉变。
氮的化学性质:
1. 氮化物反应
氮化镁与水反应:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
在放电条件下,氮气才可以和氧气化合生成一氧化氮:N2+O2=放电=2NO
一氧化氮与氧气迅速化合,生成二氧化氮2NO+O2=2NO2
二氧化氮溶于水,生成硝酸,一氧化氮3NO2+H2O=2HNO3+NO
五氧化二氮溶于水,生成硝酸,N2O5+H2O=2HNO3
2. 氮和活泼金属反应
N2与金属锂在常温下就可直接反应:6Li+N2===2Li3N
N2与碱土金属Mg、Ca、Sr、Ba在炽热的温度下作用:3Ca+N2===Ca3N2
N2与镁条反应:3Mg+N2=点燃=Mg3N2(氮化镁)
3. 氮和非金属反应
N2与氢气反应制氨气:N2+3H2===(可逆符号)2NH3
N2与硼要在白热的温度才能反应:2B+N2===2BN(大分子化合物)
N2与硅和其它族元素的单质一般要在高于1473K的温度下才能反应。
氮气用途——汽车轮胎
1.提高轮胎行驶的稳定性和舒适性
氮气几乎为惰性的双原子气体,化学性质极不活泼,气体分子比氧分子大,不易热胀冷缩,变形幅度小,其渗透轮胎胎壁的速度比空气慢约30~40%,能保持稳定胎压,提高轮胎行驶的稳定性,保证驾驶的舒适性;氮气的音频传导性低,相当于普通空气的1/5,使用氮气能有效减少轮胎的噪音,提高行驶的宁静度。
2.防止爆胎和缺气碾行
爆胎是公路交通事故中的头号杀手。据统计,在高速公路上有46%的交通事故是由于轮胎发生故障引起的,其中爆胎一项就占轮胎事故总量的70%。汽车行驶时,轮胎温度会因与地面磨擦而升高,尤其在高速行驶及紧急刹车时,胎内气体温度会急速上升,胎压骤增,所以会有爆胎的可能。而高温导致轮胎橡胶老化,疲劳强度下降,胎面磨损剧烈,又是可能爆胎的重要因素。而与一般高压空气相比,高纯度氮气因为无氧且几乎不含水份不含油,其热膨胀系数低,热传导性低,升温慢,降低了轮胎聚热的速度,不可燃也不助燃等特性,所以可大大地减少爆胎的几率。
3.延长轮胎使用寿命
使用氮气后,胎压稳定体积变化小,大大降低了轮胎不规则磨擦的可能性,如冠磨、胎肩磨、偏磨,提高了轮胎的使用寿命;橡胶的老化是受空气中的氧分子氧化所致,老化后其强度及弹性下降,且会有龟裂现象,这时造成轮胎使用寿命缩短的原因之一。氮气分离装置能极大限度地排除空气中的氧气、硫、油、水和其它杂质,有效降低了轮胎内衬层的氧化程度和橡胶被腐蚀的现象,不会腐蚀金属轮辋,延长了轮胎的使用寿命,也极大程度减少轮辋生锈的状况。
4.减少油耗,保护环境
轮胎胎压的不足与受热后滚动阻力的增加,会造成汽车行驶时的油耗增加;而氮气除了可以维持稳定的胎压,延缓胎压降低之外,其干燥且不含油不含水,热传导性低,升温慢的特性,减低了轮胎行走时温度的升高,以及轮胎变形小抓地力提高等,降低了滚动阻力,从而达到减少油耗的目的。
一氧化碳(CO)纯品为无色、无臭、无刺激性的气体。分子量28.01,密度1.250g/l,冰点为-207℃,沸点-190℃。在水中的溶解度甚低。空气混合爆炸极限为12.5%~74%。一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。因此一氧化碳具有毒性。一氧化碳是无色、无臭、无味的气体,故易于忽略而致中毒。常见于家庭居室通风差的情况下,煤炉产生的煤气或液化气管道漏气或工业生产煤气以及矿井中的一氧化碳吸入而致中毒。
物理性质:
通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
化学性质:
(1)可燃性:2CO + O2
 2CO2
2CO2 (2)还原性:
一氧化碳还原氧化铜:CO+ CuO
 Cu + CO2
Cu + CO2 一氧化碳还原氧化铁:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 一氧化碳还原四氧化三铁:4CO+ Fe3O4
 3Fe + 4CO2
3Fe + 4CO2 (3)毒性:
CO极易和血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时危及生命。CO有剧毒,人在CO的体积分数达到 0.02%的空气中持续停留2—3h即出现中毒症状,因此我们使用煤、燃气热水器时要装烟囱,注意室内通风。
用途:
用作燃料,冶炼金属。
一氧化碳和氢气的比较
| 颜色状态 | 无色,无味气体 | 无色,无味气体 |
| 密度 | 1.250g/l(略小于空气) | 0.089g/l(最轻的气体) |
| 可燃性 | 有可燃性 2CO+O2  2CO2 2CO2 |
有可燃性 2H2+O2  2H2O 2H2O |
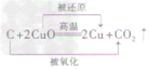
| 还原性 | 有还原性 CO+CuO  Cu+CO2 Cu+CO2 |
有还原性 H2+CuO  Cu+H2O Cu+H2O |
| 毒性 | 剧毒 | 无毒 |
| 鉴别方法 | 根据燃烧产物的不同鉴别 | |
H2、CO、C的比较
| H2 | C | CO | ||
| 可燃性 | 化学方程式 | 2H2+O2 2H2O 2H2O |
C+O2 CO2; CO2;2C+O2  2CO 2CO |
2CO+O2 2CO2 2CO2 |
| 反应现象 | 淡蓝色火焰,放热,生成 无色液体 |
发光,放热 | 蓝色火焰,放热, 生成的无色气体 能使澄清石灰水 变浑浊 | |
| 还原性 | 方程式 | 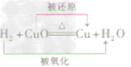 |
 |
 |
| 反应现象 | 黑色固体变红,生成无色液体,管口有水珠 | 黑色固体变红,生成的无色气体能使澄清石灰水变洪浑浊 | 黑色固体变红,生成的无色气体能使澄清石灰水变浑浊 | |
| 装置图 |  |
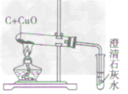 |
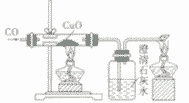 | |
| 装置要点 | 试管口略向下倾斜,导管贴试管上臂至药品上方,试管口没有橡皮塞 | 试管口略向下倾斜,导管刚过橡皮塞 | 多余的CO要进行尾气处理(如点燃) | |
| 主要步骤 | 通H2→加热→停止加热→停止通H2 | 反应结束后,先将导管从液体中取出,再停止加热 | 通CO→加热→停止加热→停止通CO | |
| 优点 | 反应条件低,生成物是水,不污染环境 | 原料便宜,操作简便 | 反应条件低 | |
| 缺点 | 不安全,操作复杂 | 反应条件高,生成物不易提纯 | 不安全,操作复杂,有毒 | |
| 用途 | 作工业原料,作高能燃料,冶炼金属 | 作燃料,冶炼金属, | 作燃料,冶炼金属, | |
(1)三种物质燃烧的现象有所不同,但不能根据火焰去鉴别CO和H2
(2)在还原CuO的实验中,必须对多余的CO进行处理
与“用下列常见的气体物质进行填空(每空只需填一个序号):①O2②N2③...”考查相似的试题有:
- 近年来,我国北京、天津、石家庄等许多城市出现雾霾天气,形成雾霾天气的是空气中PM2.5含量的增加.PM2.5指的是A.SO2B.可吸...
- 下列有关说法错误的是( )A.汽车的尾气中含有一氧化碳B.为了减少太湖水污染,应关闭沿湖地区所有的化工厂C.空气中二氧化...
- 先在A、B、C中选择一个正确选项填在相应的括号内,然后在D处再补充一个符合题意的答案。1.下列物质暴露在空气中质量会增重的...
- “西气东输”是开发西部的一项重大工程.这里所说的“气”的主要成分是( )A.一氧化碳B.氢气C.甲烷D.液化石油气
- “信息”、“材料”和“能源”被称为新科技革命的三大支柱,下列叙述不正确的是[ ]A.核能、太阳能、氢能等是具有广阔开发前景的新...
- 运动会的发令枪,所用的“火药”是用氯酸钾和红磷混合制成的,一经撞击两种物质就剧烈反应,发出响声并产生白烟。白烟的成分是A...
- 许多物质在人类的生存、日常生活和工农业生产中,有着极其广泛的用途.现有生石灰、氧气、二氧化碳、氮气,请从中选择与下列...
- 空气中含量最多的单质是( )A.N2B.O2C.HeD.CO2
- 善于归纳知识,利于培养素质。小林同学整理的下列内容有错误的是[ ]A.除杂的方法粗盐提纯--溶解、过滤、蒸发木炭粉中混有铁...
- 下列观点你认为不正确的是( )A.氢气让人欢喜让人忧B.煤气能提高人们的生活质量,同时也潜伏着无形杀手C.煤为人类提供能...