本试题 “下列实验原理、装置、试剂选用、结论正确的是( )A.用湿润的pH试纸测定稀盐酸的pHB.用下图1构成锌-铜原电池C.用下图2根据有关实验现象推知酸性:CH3COOH...” 主要考查您对原电池原理
电解池原理
卤代烃
pH值的测定
化学科学探究
实验操作达到的预期目的
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原电池原理
- 电解池原理
- 卤代烃
- pH值的测定
- 化学科学探究
- 实验操作达到的预期目的
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:
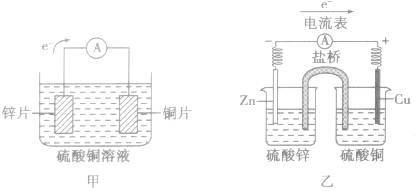
(2)原理图:
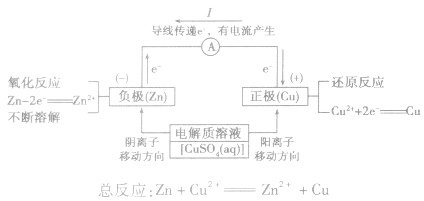
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


卤代烃:
1.卤代烃的定义
烃分子中的氢原子被卤素原于取代后生成的化合物,称为卤代烃,可用R—X(X为卤素原子)表示。在卤代烃分子中,卤素原子是官能团。由于卤素原子吸引电子的能力较强,使共用电子对偏移,c—x键具有较强的极性,因此卤代烃的反应活性增强。
2.卤代烃的分类 (1)根据分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃和碘代烃。
(2)根据分子中所含卤素原子个数的不同,分为一卤代烃和多卤代烃。
(3)根据烃基结构不同,分为卤代烷烃、卤代烯烃、卤代芳香烃等。
卤代烃的性质:
1.卤代烃的物理性质
(1)常温下,卤代烃中除一氯甲烷、氯乙烷、氯乙烯等少数为气体外,其余为液体或固体。
(2)一氯代烷的物理性质:随着碳原子数增加,其熔、沸点和密度逐渐增大(沸点和熔点大于相应的烃)。
(3)难溶于水,易溶于有机溶剂,除脂肪烃的一氟代物、一氯代物等部分卤代烃外,液态卤代烃的密度一般比水大。密度一般随烃基中碳原子数增加而增大。
2.卤代烃的化学性质与C2H5Br相似,可以发生水解反应和消去反应
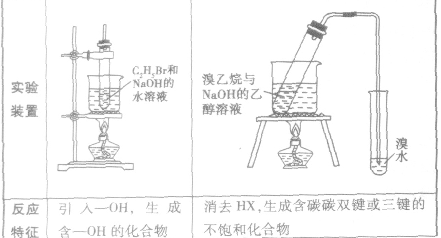

卤代烃中卤素的检验:
1.实验原理
根据AgX的颜色(白色、淡黄色、黄色)可确定卤素(氯、溴、碘):
2.实验步骤
①取少量卤代烃;
②加入NaOH溶液;
③加热煮沸;
④加入过量稀硝酸酸化;
⑤加入AgNO3溶液。
3.实验说明加热煮沸是为了加快水解速率,因不同的卤代烃水解难易程度不同;加入过量稀硝酸酸化是为了中和过量的NaOH,防止NaOH与AgNO3反应,干扰实验现象,同时也是为了检验生成的沉淀是否溶于稀硝酸。
卤代烃在有机物转化和合成中的重要桥梁作用:
1.一元代物与二元代物之间的转化关系 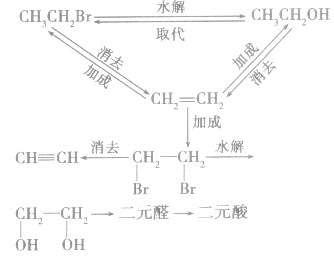
2.卤代烃的桥梁作用通过烷烃、芳香烃与X2发生取代反应,烯烃、炔烃与X2、HX发生加成反应等途径可向有机物分子中引入一X;而卤代烃的水解和消去反应均消去一X。卤代烃发生取代、消去反应后,可在更大的空间上与醇、醛、酯相联系。引入卤素原子常常是改变性能的第一步,卤代烃在有机物转化、推断、合成巾具有“桥梁”的重要地位和作用。
溴乙烷:
1.分子结构
分子式: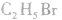
结构式: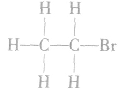
电子式: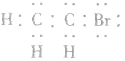
结构简式: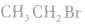
2.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点为38.4℃,密度比水大,难溶于水,易溶于乙醇等多种有机溶剂。
3.溴乙烷的化学性质
(1)水解反应:溴乙烷在NaOH存在的条件下可以跟水发生反应生成乙醇和溴化氢。 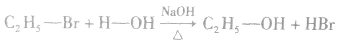
说明:溴乙烷的水解反应又属于取代反应。
溴乙烷水解生成的HBr与NaOH易发生中和反应,水解方程式也可写为:

(2)消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX)而生成含不饱和键(双键或三键)化合物的反应,叫做消去反应。
溴乙烷与强碱(NaOH或KOH)的乙醇溶液共热,从溴乙烷分子中脱去HBr,生成乙烯: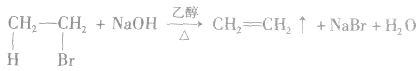
pH的测定:
1.酸碱指示剂法:只能粗略测定溶液的pH范围
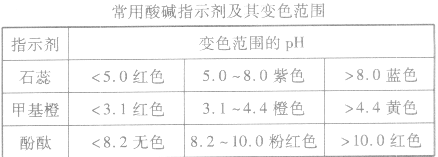
2.pH试纸法:用洁净的玻璃棒蘸取待测溶液点在一小片pH试纸(干燥的)的中部,变色后与标准比色卡对照,读出溶液的pH(粗略的整数值)。
3.pH计法(酸度计):能精确测定溶液的pH(精确到小数点后两位)。
四个环节:查阅资料、提出假设、实验探究、结论分析
提出问题→猜想假设→制定计划→进行实验→收集证据→解释与结论→反思与评价 →表达与交流
(1)①用托盘天平称取5.6g氧化铜粉末(托盘天平能准确到0.1克,所以用托盘天平称取5.6g氧化铜粉末是可以的)
②用10mL水和10mL酒精配制成20mL酒精溶液(由于分子间有间隔,10mL水和10mL静静混合后体积,不能配制成20mL酒精溶液)
③用排水集气法可收集到比较纯净的氧气(收集到的气体要比排空气法收集到的气体纯,由于空气的密度与氧气的密度相差不是很大,所以排空气法收集到的气体氧气不是很纯)
④用10mL量筒量取8.2mL水(10mL量筒精确到0.1mL,所以能量取8.2mL水)
(2) ①分别加入饱和碳酸钠溶液,鉴别乙酸乙酯和乙酸(观察到有气泡产生的是乙酸,能到到鉴别的目的)
②分别加入少量金属钠,比较水和乙醇中羟基氢的活泼性(通过观察与金属钠反应的剧烈程度可以判断羟基的活泼性,能达到目的)
③分别加入浓硝酸,比较铁和铜的金属活动性(铁和铜都能和浓硝酸反应,不能达到比较金属活动性的目的)
与“下列实验原理、装置、试剂选用、结论正确的是( )A.用湿润...”考查相似的试题有:
- 下列装詈能否组成原电池?并判断其正负极。______________________________________
- 把a、b、c三块金属片浸人稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;a、c相连时c极上产生大量气泡;b、c相...
- 铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O = Fe(OH)2+ Ni(OH)2下列有关该电池的说法不正确的是[ ]A.电池的...
- Ⅰ.X、Y、Z是短周期元素的三种常见氧化物.X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是______;Y和X组成...
- 近年来我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。在汽车上安装三效催化转化器,可使汽车尾气中的主要...
- 关于如图所示装置的叙述正确的是[ ]A.甲乙装置中的锌片都作负极B.甲乙装置中的溶液内的H+都是在铜片上被还原C.甲乙装置中...
- (5分)课本的第27页介绍了一种热带雌蚕蛾为了吸引同类雄蛾会分泌出叫“蚕蛾醇”的物质。蚕蛾醇有多种顺反异构体,如请回答:(...
- 目前有部分学生在做作业或考试时,喜欢使用修正液.经实验证明,修正液中含有多种挥发性有害物质,吸入后易引起头晕、头痛,...
- (15分)某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为(其中I、II为未知部分的结构):。为推测X的分子结构,...
- 下列叙述正确的是( )A.用湿润的pH试纸测溶液的pHB.用蒸馏法可将海水淡化为可饮用水C.常温下浓硫酸不能盛放在铝制容器中D...