本试题 “恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g)⇌xC (g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mo...” 主要考查您对达到化学平衡的标志
化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 达到化学平衡的标志
- 化学平衡的有关计算
化学平衡移动的含义:
1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,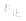 >
>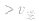 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;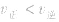 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。
化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等: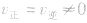 。
。
(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使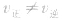 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
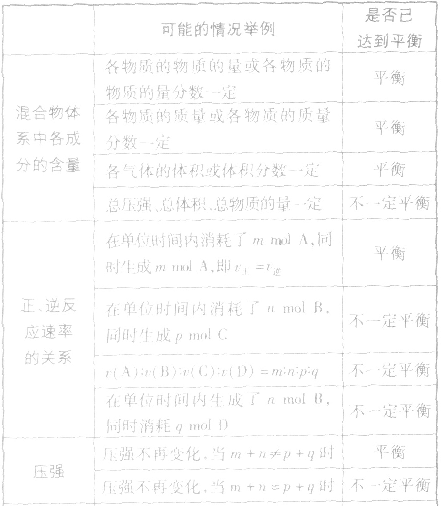
化学平衡状态的判断:
1.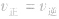 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。
2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应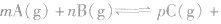 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

1.当一个可逆反应达到平衡状态后,如果改变温度、压强、浓度等反应条件.原来的平衡状态会被破坏,化学平衡会发生移动,平衡混合物中各组成物质的质量分数也就随着改变,在一段时间后达到新的平衡状态,这种由原平衡状态向新平衡状态的变化过程。就是化学平衡的移动。以上过程可归纳如下:

2.化学平衡移动与化学反应速率的关系
当与化学平衡体系有天的外界条件改变以后,
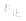 >
>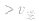 ,化学平衡向正反应方向移动;
,化学平衡向正反应方向移动; ,化学平衡不移动;
,化学平衡不移动;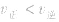 ,化学平衡向逆反应方向移动。
,化学平衡向逆反应方向移动。化学平衡状态:
(1)定义:在一定条件下的可逆反应中,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
(2)化学平衡的建立对于可逆反应,不管从正反应开始(只投入反应物),还是从逆反应开始(只投入生成物),或从正、逆反应同时开始(同时投入反应物和生成物),在一定条件下都会达到
 的状态。当
的状态。当 相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。
相等时,单位时间内同一物质消耗与生成的量完全相等,因而各物质的浓度和百分含量保持一定,即达到化学平衡状态。构成化学平衡体系的基本要求是反应物和所有的生成物均处于同一反应体系中,反应条件(温度、浓度、压强等)保持不变。 化学平衡的特征:
(1)逆:只有可逆反应才能达到化学平衡状态。
(2)动:是动态平衡,正、逆反应仍在不断进行。
(3)等:
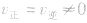 。
。(4)定:各组分的浓度及百分含量保持一定。
(5)变:当影响化学平衡的外界条件发生变化使
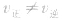 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。化学平衡状态的判断:
1.
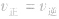 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。 2.反应混合物中各组分的含量(质量分数、体积分数、物质的量分数)保持不变。
3.反应类型分析对于密闭容器中的反应
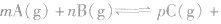 qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。

化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
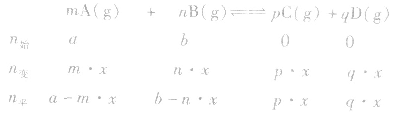
则有:

(2)对于反应物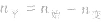 ,对于生成物
,对于生成物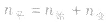
(3)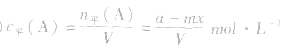
(4)A的转化率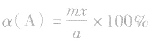
(5)平衡时A的体积(物质的量)分数
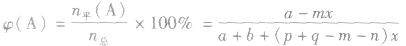
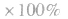
(6)
(7)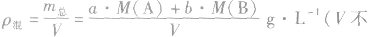
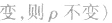
(8)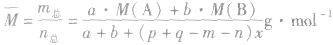
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
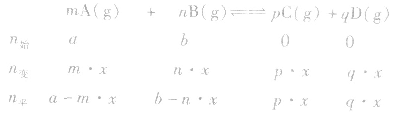
则有:

(2)对于反应物
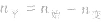 ,对于生成物
,对于生成物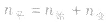
(3)
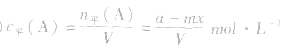
(4)A的转化率
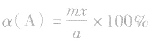
(5)平衡时A的体积(物质的量)分数
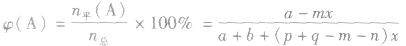
(6)

(7)
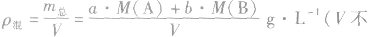
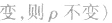
(8)
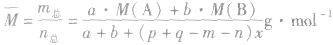
发现相似题
与“恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生...”考查相似的试题有:
- 制取硝酸铵的流程图如下:请回答下列问题:(1)合成氨的原料通常各来自何处?(2)已知N2(g)+3H2(g)2NH3(g),Q>0。请...
- I2在KI溶液中存在下列平衡:某I2、、KI混合溶液中, 的物质的量浓度c()与温度T的关系如图所示(曲线上任何一点都表示平衡状态...
- 在2 L的密闭容器中进行反应3H2+N2 2NH3,经过一段时间后,NH3的物质的量增加0.8 mol,在这段时间内用N2表示的反应速率为0.01 ...
- 在恒定温度下反应NH2COONH4(s)2NH3(g)+CO2(g)达到分解平衡:(1)可以判断该分解反应已经达到化学平衡的是________。A.2v(NH3)...
- 在温度、初始容积相同的3个密闭容器中,按不同方式投入反应物,发生如下反应:3 X(g)+Y(g)xZ(g) ΔH<0保持温度不变,测得反...
- 在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O(g)发生反应:CO(g)+H2O(g)CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mo...
- 在密闭容器中发生如下反应:xA(g)+yB(g)zC(g),达到平衡后测得A的浓度为0.20mol/L。在恒温下增大压强使容器容积缩小为原来的一...
- 下列说法正确的是( )A.密闭容器中充入1mol N2和3mol H2可生成2mol NH3B.一定条件下,可逆反应达到平衡状态,该反应就达到...
- 在一固定容积的密闭容器中进行如下反应:其平衡常数K和温度,的关系如下:(1)该反应的平衡常数K的表达式为________________...
- 下列事实不能用勒夏特列原理解释的是( )A.开启啤酒瓶后,瓶中立刻泛起大量泡沫B.由H2、I2蒸气、HI组成的平衡体系加压后颜色...