本试题 “下列叙述正确的是( )A.氯化钠在电流作用下电离成钠离子和氯离子B.凡是能够电离出H+的化合物都是酸C.蔗糖能溶于水,但蔗糖不属于电解质D.醋酸溶液中存在...” 主要考查您对电解质、非电解质
强电解质电离(氯化钠、硫酸氢钠等物质的电离)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解质、非电解质
- 强电解质电离(氯化钠、硫酸氢钠等物质的电离)
电解质和非电解质:
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
强电解质电离:
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
强电解质在溶液中完全电离,且符号为“=”,如NaCl=Na++Cl-、NaHSO4==Na++H++SO42-
酸与碱反应的几种情况:
1.等体积、等物质的量浓度的酸 混合
混合 
2.等体积的酸 混合
混合 
3.若酸 等体积混合溶液呈中性
等体积混合溶液呈中性 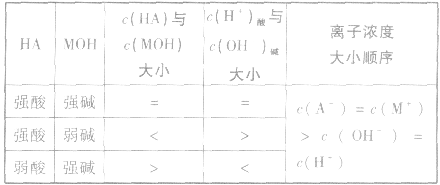
4.强酸溶液(pH=a)与强碱溶液(pH=b)完全中和时的体积比

发现相似题
与“下列叙述正确的是( )A.氯化钠在电流作用下电离成钠离子和...”考查相似的试题有:
- 下列电离方程式书写正确的是( )A.Na3PO4=3Na++B.Ba(OH)2=Ba2++C.CH3COOH=CH3COO-+H+D.NaHCO3=Na++H++
- 以下物质:①铝 ②氯气 ③液氯 ④氨水 ⑤液态HCl ⑥熔融KNO3⑦蔗糖 ⑧BaSO4晶体 ⑨乙醇(填序号)其中能导电的是______,属于电解质的...
- 下列各组物质,前者属于电解质,后者属于非电解质的是[ ]A.NaCl晶体、BaSO4B.铜、二氧化硫C.液态的醋酸、酒精D.熔融的KNO...
- 下列物质是属于非电解质的是( )A.NH3B.(NH4)2SO4C.Cl2D.NaOH固体
- 下列按纯净物、混合物、电解质和非电解质顺序排列的是[ ]A.盐酸、空气、醋酸、干冰B.冰醋酸、福尔马林、硫酸钠、乙醇C.蛋...
- 下列物质属于强电解质的是 ( )A.NaCl溶液B.BaSO4C.CuD.HClO
- 下列物质中,不是电解质溶液的是( )A.医用酒精B.HCl溶液C.蔗糖溶液D.稀硫酸
- 下列属于弱电解质的是A.H2SO4B.KOHC.H2OD.BaCl2
- 下列物质:①H2O②石墨③NH4NO3④液态氯化氢⑤冰醋酸⑥蔗糖属于强电解质的是______;属于弱电解质的是______;属于非电解质的是____...
- 溶液中存在有五种离子,其中各离子个数比Cl-:SO42-:Fe3+:K+:M=2:3:1:3:1,则M为( )A.CO32-B.Mg2+C.Na+D.Ba2+