本试题 “将下列液体分别与溴水混合并振荡,静置后分为两层,两层几乎均呈无色的是[ ]A.氯水B.己烯C.苯D.碘化钾溶液” 主要考查您对氯水
烯烃的通性
苯
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氯水
- 烯烃的通性
- 苯
氯水的成分:
新制氯水中存在的分子有盐酸(HCl)、次氯酸(HClO),水(H2O)、还有氯气
氯水的性质:
新制氯水呈黄绿色、有刺激性气味,属于混合物,其所含的多种微粒使氯水的化学性质表现出多重性。
①氯水的Cl2氧化性,只表现氯水的氧化性
A. 在某些含非金属阴离子的溶液中加氯水。
| 氯水滴加溶液 | 反应方程式 | 实验现象 |
| KI溶液 | 2KI+Cl2==2KCl+I2 | 溶液由无色变橙黄色 |
| NaBr溶液 | 2NaBr+Cl2==NaCl+Br2 | 溶液由无色变橙色 |
| K2S溶液 | K2S+Cl2==2KCl+S↓ | 溶液变浑浊 |
| Na2SO3溶液 | Na2SO3+Cl2+H2O==Na2SO4+2HCl | 氯水颜色褪去 |
C. 某些强还原性的气体通入氯水中,氯气将其氧化。
| 通入的气体 | 化学方程式 | 实验现象 |
| H2S | H2S+Cl2==2HCl+S↓ | 溶液出现浑浊 |
| HBr | 2HBr+Cl2==2HCl+Br2 | 溶液由浅黄绿色变橙色 |
| HI | 2HI+Cl2==2HCl+I2 | 溶液由浅黄色变橙黄色 |
| SO2 | SO2+Cl2+2H2O==H2SO4+2HCl | 溶液浅黄色褪去 |
A. 新制氯水滴入NaOH溶液等强碱溶液中,氯水褪色:
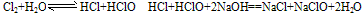
B. 新制氯水中滴加紫色石蕊试液时,溶液先变红色,后褪色,是盐酸的强酸性和次氯酸的强氧化性共同作用的结果。 ③氯水中次氯酸的强氧化性。
新制氯水起漂白作用时,是由于HClO的强氧化性将色素氧化使之褪色的结果,也是Cl2的漂白、杀菌、消毒作用必须有水存在的根本原因。
④氯水中盐酸的强酸性。
在AgNO3溶液中滴加适量的氯水,有白色沉淀生成。是氯水中的HCl与AgNO3作用的结果。
⑤氯水中盐酸的强酸性和氯气的强氧化性共同起作用。
向氯水中加镁粉、铝粉等活泼金属时,可观察到氯水颜色褪去且有气泡冒出,氯水中的Cl2和HCl与镁、铝共同作用的结果。
有关氯水问题的分析方法:
1.氯水性质的多样性
氯气溶于水形成的溶液叫氯水,新制的氯水呈浅黄绿色,有刺激性气味。氯水中存在三个平衡:
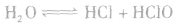 ,
,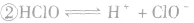 ,
,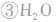
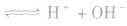 。所以,在氯水中存在三种分子:Cl2、 H2O、HClO;四种离子:H+、Cl-、ClO-及少量OH-。由于在光照条件下HClO可分解
。所以,在氯水中存在三种分子:Cl2、 H2O、HClO;四种离子:H+、Cl-、ClO-及少量OH-。由于在光照条件下HClO可分解
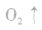 ,故久置的氯水为盐酸。
,故久置的氯水为盐酸。
(1)氯水的性质氯水在与不同物质发生反应时,表现出成分的复杂性和性质的多样性。
说明:
①氯水通常现用现制,可短时间密封保存于棕色试剂瓶中(见光或受热易分解的物质均保存在棕色试剂瓶中);
②Cl:使湿润的蓝色石蕊试纸先变红,后褪色。
(2)新制氯水、久置氯水、液氯的区别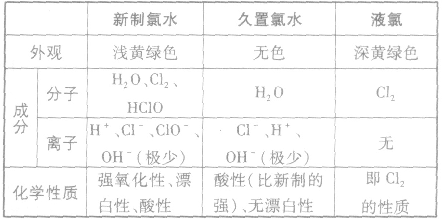
外界因素对平衡 的影响:
的影响:
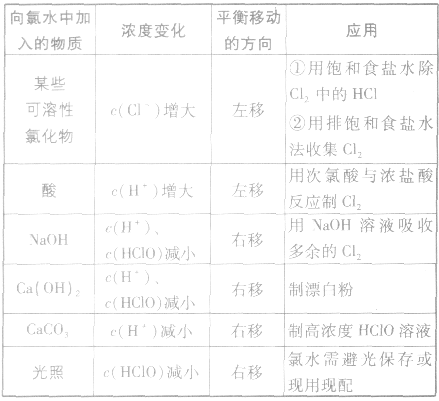
卤离子的检验方法:
1.银盐法:
特别提醒:加入稀HNO3的目的是防止CO32-、 PO43-等离子的干扰。有关反应为: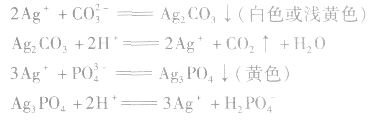
2.置换一萃取法
3.置换一淀粉法检验I-
烯烃的通性:
(1)物理性质:随着分子中碳原子数的递增,熔沸点逐渐升高,相对密度逐渐增大,常温下存在状态,由气态逐渐过渡到液态、固态。
(2)化学性质:烯烃可发生氧化、加成、加聚等反应。
①烯烃的氧化反应:烯烃燃烧生成二氧化碳和水。CnH2n+3n/2O2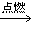 nCO2+nH2O
nCO2+nH2O
②烯烃的加成:烯烃可与氢气、卤素单质、水、卤化氢等发生加成反应。烯烃的加聚反应:以乙烯为例: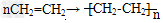 ,加聚时碳碳双键打开。
,加聚时碳碳双键打开。
③二烯烃的加成反应:以1,3-丁二烯(CH2=CH-CH=CH2)加成为例
1,2加成就是加成普通的不饱和键,和普通的烯烃和炔烃的加成一样。与氯气加成:CH2=CH-CH=CH2+Cl2→CH2Cl-CHCl-CH=CH2
1,4加成,1,4加成是分别加成两边的2个不饱和键,然后在中间重新形成一个双键。与氯气加成:CH2=CH-CH=CH2+Cl2→CH2Cl-CH=CHCH2Cl
(3)烯烃的顺反异构:根据在两个由双键连接的碳原子上所连的四个原子或基团中两个相同者的位置来决定异构体的类型。当两个相同的原子或基团处于π键平面的同侧时称“顺式异构(cis-isomerism)”;当处于π键平面的异侧时称“反式异构(trans-isomerism)”。Z表示顺,E表示反。 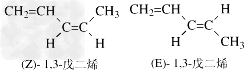
苯的分子结构:
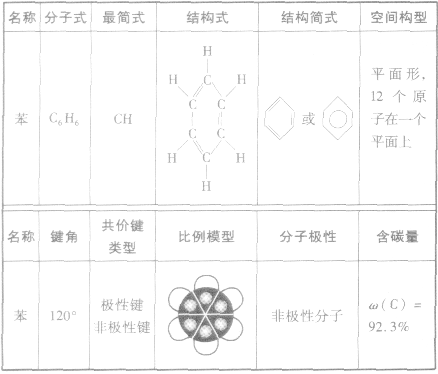
苯的性质:
1.物理性质苯通常是无色、带有特殊气味的液体,有毒,不溶于水,密度比水小,熔点为5.5℃,沸点为80.1℃。若用冰冷却,苯就会凝结成无色的晶体。
2.化学性质由于苯分子中的碳碳键是介于碳碳单键与碳碳双键之间的独特的键,所以它既有饱和烃的性质,又有不饱和烃的一些性质(苯的性质比不饱和烃的性质稳定)。
(1)氧化反应
①燃烧:苯易燃烧,所以在苯的生产、运输、贮存和使用过程中要注意防火。苯在空气中燃烧时有明亮火焰斤带有浓烟。因为苯分子含碳量高,没有得到充分燃烧,有碳单质产生,所以燃烧时有浓烟。
②苯与酸性高锰酸钾溶液不反应向试管中加入2mL苯,然后加入几滴酸性高锰酸钾溶液,振荡后静置,出现分层现象,上层(苯层)为无色,下层(水层)呈紫色。说明苯与酸性高锰酸钾溶液不反应。 
(2)取代反应
①卤代反应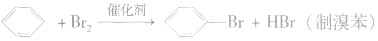
装置图如下图所示。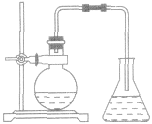
操作:把苯和少量液溴放在烧瓶里,同时加入少量铁屑作催化剂。用带导管的瓶塞塞紧瓶口,跟瓶口垂直的一段导管可以起冷凝器的作用。现象:在常温时,很快就会看到在导管口附近出现白雾(由溴遇水蒸气所形成)。反应完毕后,向锥形瓶内的液体里滴入AgNO3溶液,有浅黄色沉淀生成。把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有褐色不溶于水的液体(不溶于水的液体是溴苯,它是密度比水大的无色液体,由于溶解了溴而显示褐色)。
注意
a.苯只能与液溴发生取代,不与溴水反应,溴水中的溴只可被苯萃取。
b.反应中加入的催化剂是Fe屑,实际起催化作用的是FeBr3
c.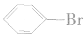 生成的是无色液体,密度大于水。
生成的是无色液体,密度大于水。
d.欲得到较纯的溴苯,可用稀NaOH溶液洗涤,以除去Br2。
②硝化反应
硝化反应是指苯分子中的氢原子被一NO2所取代的反应,也属于取代反应的范畴。 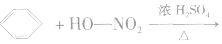

注意
a.硝酸分子中的“一NO2”原子团叫做硝基,要注意硝基(一NO2)与亚硝酸根离子(NO2-)化学式的区别。
b.硝基苯是一种带有苦杏仁味的、无色的油状液体,不溶于水,密度比水大。硝基苯有毒。
c.为便于控制温度,采用水浴加热。
(3)加成反应
苯分子中的碳碳键不是典型的碳碳双键,不容易发生加成反应(不能使溴的四氯化碳溶液褪色),但在一定条件下可与氢气发生加成反应,生成环己烷,反应的化学方程式为: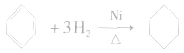
与“将下列液体分别与溴水混合并振荡,静置后分为两层,两层几乎...”考查相似的试题有:
- (5分)现将0.1mol某烃完全燃烧生成的气体全部依次通过浓硫酸和氢氧化钠溶液,经测定,前者增重10.8g,后者增重22g(假定气体...
- 某有机物的结构如图所示,关于该有机物的性质叙述错误的是[ ]A.不能与氢气反应B.能使溴水褪色C.能发生酯化反应D.能与NaOH...
- 下列关于有机物的说法不正确的是A.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NAB.分子式分别为C2H6、C5H12的...
- 反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2②2NaI...
- 根据的结构,它不可能发生的反应是[ ]A.与酸性高锰酸钾溶液发生氧化反应B.使溴的四氯化碳溶液褪色C.与乙醇在浓硫酸催化下...
- 化学上将SCN-、OCN-、CN-等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成红色。将此红色溶液分成...
- 分子式为C5H12O的有机物,它的同分异构体中,经氧化可生成醛的有A.4种B.3种C.2种D.5种
- 纳豆是一种减肥食品,从其中分离出一种由C、H、O三种元素组成的有机物A,为确定其结构现进行如下实验:①相同条件下,测得A的...
- 分子式为C8H10的芳香烃,其苯环上的一氯代物只有两种的是( )
- 苯分子中六个碳-碳键是完全等同的,不是单双键交替结构,下列事实不能证明这一结论的是A.苯的一氯代物只有一种B.苯的二氯代...