本试题 “如下图所示装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答(1)a为_________极,c极的电极反应式...” 主要考查您对电解池原理
电化学有关的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解池原理
- 电化学有关的计算
电解池:
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
(1)电解:使电流通过电解质溶液且在阴、阳极两极引起氧化还原反应的过程叫电解。
(2)装置:电解池(电解槽)
(3)特点:将电能转化为化学能。
形成条件:①与电源相连的两个电极,②电解质溶液或熔融电解质,③形成闭合回路
(4)阴离子放电顺序:S2->I->Br->Cl->OH->SO42->NO3->F- 阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(5)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2(消耗H+),阳极上无O2产生,电解后溶液pH值增大;
②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;
③若阴极上有H2,阳极上有O2,且(相当于电解水),则有三种情况:
a如果原溶液为中性溶液,则电解后pH值不变;
b如果原溶液是酸溶液,则pH值变小;
c如果原溶液为碱溶液,则pH值变大;
④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。如电解CuCl2溶液(CuCl2溶液由于Cu2+水解显酸性),一旦CuCl2全部电解完,pH值会变大,成中性溶液。
(6)电解反应类型:从参加反应的物质来分电解反应可分成五类:
①H2O型:实质是电解水。如电解硝酸钠、氢氧化钠、硫酸等溶液。
②溶质型:溶质所电离出来的离子发生氧化还原,如电解氯化铜、溴化氢等溶液。
③硫酸铜溶液型:电解产物是金属、氧气与酸。如电解硫酸铜溶液生成单质铜、氧气和硫酸,电解硝酸银溶液时生成单质银、氧气和硝酸。
④氯化钠溶液型:电解产物是非金属单质、氢气与碱。如电解氯化钠溶液时生成氯气、氢气和氢氧化钠,电解溴化钾溶液时生成溴单质、氢气和氢氧化钾。
⑤电镀型:镀层金属作阳极,阳极反应是:M-ne-=Mn+,镀件作阴极,阴极反应是:Mn++ne-=M。(电解精炼与电镀,实质上是相同的)
原电池、电解池、电镀池的比较:


电化学计算的基本方法和技巧:
原电池和电解池的计算包括两极产物的定量计算、溶液的pH计算、相对原子质量的计算,根据电量求产物的量或根据产物的量求电量等。通常有下列三种方法。
1.根据电子守恒法
计算用于串联电路中阴、阳两极产物或正、负两极产物的量的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
3.根据关系式计算
运用得失电子守恒建立已知量与未知量之间的关系式。如以通过4mole一为桥梁可构建电极产物之间的如下关系式: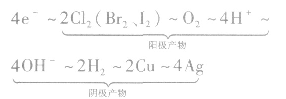
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用这个关系式便能快速解答常见的电化学计算问题。
特别提醒:在电化学计算中,还常利用 和
和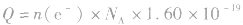 来计算电路中通过的电量。
来计算电路中通过的电量。
发现相似题
与“如下图所示装置中,b电极用金属M制成,a、c、d为石墨电极,接...”考查相似的试题有:
- 关于下列各装置图的叙述中,不正确的是( )A.装置①中,d为阳极、c为阴极B.装置②可用于收集H2、CO2、Cl2、HCl、NO2等气体(...
- 如图所示,在一U型管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,从左到右颜...
- 如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连...
- 下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液.(1)该转化系统可以循环使用的化合物是______.(2...
- 如图,外接电源为Zn-MnO2干电池,甲、乙为相互串联的两个电解池,请回答:(1)甲池若为用电解原理精炼铜的装置,B电极是____...
- 下列各装置中,能构成原电池的是( )A.B.C.D.
- 用如图所示装置制取纯净的Fe(OH)2,下列说法不正确的是A.a电极一定是铁,电解液c可以是CuCl2溶液B.电解一段时间,b电极附近...
- 工业上生产MnO2和Zn的主要反应有:①MnO2(矿石)+ZnS+2H2S4=MnSO4+ZnSO4+S+2H2O②MnSO4+ZnSO4+2H2O 电解 . MnO2+Zn+2H2SO4下列...
- 用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )A...
- 两串联的电解池,甲池盛有CuSO4溶液,乙池盛有一定量某硝酸盐的稀溶液,用惰性电极电解,当甲池的阴极上析出1.6gCu时,乙池...