本试题 “根据物质的特征对物质进行分类是我们学习和研究化学时常用的方法.采用不同的分类标准,可以对同一组物质进行不同的分类.现有Fe、H2、CO2、NaOH、NaCl、CaCO...” 主要考查您对元素的定义
物理性质和化学性质的区别和应用
酸的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 元素的定义
- 物理性质和化学性质的区别和应用
- 酸的性质
概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
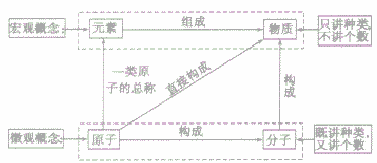
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;

在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
物理性质:
1. 概念: 不需要发生化学变化就直接表现出来的性质。
2. 实例:在通常状态下,氧气是一种无色,无味的气体。
3. 物质的物理性质:如颜色,状态,气味,熔点,沸点,硬度等。
化学性质:
1. 概念:物质在化学变化中表现出来的性质,如铁在潮湿的空气中生成铁锈,铜能在潮湿的空气中生成铜绿。化学性质只能通过化学变化表现出来。
物质的性质和用途的关系:
若在使用物质的过程中,物质本身没有变化,则是利用了物质的物理变化,物质本身发生了变化,变成了其他物质,则是利用了物质的化学性质。物质的性质与用途的关系:物质的性质是决定物质用途的主要因素,物质的用途体现物质的性质。
物质的性质与物质的变化的区别和联系
| 物质的性质 | 物质的变化 | |
| 区别 | 物质的性质是指物质的特有属性,不同的物质其属性不同,是变化的内因 | 物质的变化是一个过程,是有序的,动态的,性质的具体体现 |
| 联系 | 物质的性质决定了它能发生的变化,而变化又是性质的具体表现 | |
判断是“性质”还是“变化”:
判断某种叙述是指物质的“性质”还是“变化”时,首先要准确把握它们的区别和联系,若叙述中有“能”,“难”,“易”,“会”,“就”等词语,往往指性质,若叙述中有“已经”,“了”,“在”等词语,往往指物质的变化。
有关描述物质的词语:
1. 物理性质:
(1)熔点
物质从固态变成液态叫熔化,物体开始熔化时的温度叫熔点。
(2)沸点
液体沸腾时的温度叫沸点。
(3)压强
物体在单位面积上所受到的压力叫压强。
(4)密度
物质在单位体积上的质量叫密度,符号为p。
(5)溶解性
一种物质溶解在另一种物质里的能力,称为这种物质的溶解性。溶解性跟溶质、溶剂的性质及温度等因素有关。
(6)潮解
物质在空气中吸收水分,表面潮湿并逐渐溶解的现象。如固体、NaOH,精盐在空气中易潮解。
(7)挥发性
物质由固态或液态变为气体或蒸气的过程二如浓盐酸具有挥发性,可挥发出氯化氢气体
(8)导电性
物体传导电流的能力叫导电性:固体导电靠的是白由移动的电子,溶液导电依靠的是自由移动的离子
(9)导热性
物体传导热量的能力叫导热性。一般导电性好的材料,其导热性也好。
(10)延展性
物体在外力作用下能延伸成细丝的性质叫延性;在外力作用下能碾成薄片的性质叫展性。二者合称为延展性,延展性一般是金属的物理性质之一。
2. 化学性质:
(1)助燃性物质在一定的条件下能进行燃烧的性质。如硫具有可燃性。
(2)助燃性物质能够支持燃烧的性质。如氧气具有助燃性
(3)氧化性在氧化还原反应中,能够提供氧元素的性质
(4)还原性在氧化还原反应中,能够夺取含氧化合物中氧元素的性质,初中化学常见的还原性物质(即还原剂)有 H2、CO、C。
(5)酸碱性酸碱性是指物质能够使酸碱指示剂变色的性质: 酸性溶液能使紫色石蕊变红,碱性溶液能使紫色石蕊变蓝。
(6)稳定性物质不易与其他物质发生化学反应或自身不易发生分解反应的性质,如稀有气体化学性质稳定。
(7)风化结晶水合物(如Na2CO3·10H2O)在干燥的环境中失去结晶水的性质。
定义:
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
化学上是指在溶液中电离时阳离子完全是氢离子的化合物。
酸的通性:
(1)跟指示剂反应 紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色
(2)跟活泼金属(金属活动性顺序表中比氢强的金属)发生置换反应酸+金属=盐+氢气 例:2HCl+Fe=FeCl2+H2↑
(3)跟碱性氧化物反应酸+碱性氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(4)跟某些盐反应酸+盐→新酸+新盐 H2SO4+BaCl2=2HCl+BaSO4↓
(5)跟可溶性碱发生中和反应酸+碱→盐+水 2HCl+Ba(OH)2=BaCl2+2H2O
常见酸的性质:
(1)盐酸是氯化氢的水溶液,是一种混合物。纯净的盐酸是无色的液体,有刺激性气味。
工业浓盐酸因含有杂质(Fe3+)带有黄色。浓盐酸具有挥发性,打开浓盐酸的瓶盖在瓶口
立即产生白色酸雾。这是因为从浓盐酸中挥发出来的氯化氢气体跟空气中水蒸汽接触,形
成盐酸小液滴分散在空气中形成酸雾。
(2)硫酸是一种含氧酸,对应的酸酐是SO3。纯净的硫酸是没有颜色、粘稠、油状的液体,不易挥发。稀H2SO4具有酸的通性。浓硫酸除去具有酸的通性外,还具有三大特性:
①吸水性: 浓H2SO4吸收水形成水合硫酸分子(H2SO4·nH2O),并放出大量热,所以浓硫酸通常用作干燥剂。
②脱水剂: 浓硫酸可将有机化合物中的氢原子和氧原子按水分子的构成(H:O=2:1)夺取而使有机物脱水碳化。纸、木柴、衣服等遇浓硫酸变黑,这就是因为浓硫酸的脱水性使其碳化的缘故。
③强氧化性:
在浓硫酸溶液中大量存在的是H2SO4分子而不是H+,H2SO4分子具强氧化性。
浓硫酸可使金属活动性顺序表氢后面的一些金属溶解,可将C、S等非金属单质氧化,而浓硫酸本身还原成SO2。但是,冷的浓硫酸不能与较活泼的金属Fe和Al反应。原因是浓硫酸可以使Fe和Al的表面形成一层致密的氧化物薄膜,阻止了里面的金属与浓硫酸继续反应,这种现象在化学上叫钝化。由于浓硫酸有脱水性和强氧化性,我们往蔗糖上滴加浓硫酸,会看到蔗糖变黑并且体积膨胀。又由于浓硫酸有吸水性,浓盐酸有挥发性,所以,往浓盐酸中滴加浓硫酸会产生大量酸雾,可用此法制得氯化氢气体。
(3)硝酸也是一种含氧酸,对应的酸酐是N2O5,而不是NO2。
纯净的硝酸是无色的液体,具有刺激性气味,能挥发。打开浓硝酸的瓶盖在瓶口会产生白色酸雾。浓硝酸通常带黄色,而且硝酸越浓,颜色越深。这是因为硝酸具有不稳定性,光照或受热时分解产生红棕色的NO2气体,NO2又溶于硝酸溶液中而呈黄色。所以,实验室保存硝酸时要用棕色(避光)玻璃试剂瓶,贮存在黑暗低温的地方。硝酸又有很强的腐蚀性,保存硝酸的试剂瓶不能用橡胶塞,只能用玻璃塞。
硝酸除具有酸的通性外,不管是稀硝酸还是浓硝酸都具有强氧化性。硝酸能溶解除金和铂以外的所有金属。金属与硝酸反应时,金属被氧化成高价硝酸盐,浓硝酸还原成NO2,稀硝酸还原成NO。但是,不管是稀硝酸还是浓硝酸,与金属反应时都没有氢气产生。较活泼的金属铁和铝可在冷浓硝酸中钝化,冷浓硝酸同样可用铝槽车和铁罐车运输和贮存。硝酸不仅能氧化金属,也可氧化C、S、P等非金属。
浓H2SO4为什么能做干燥剂:
因为浓H2SO4有强烈的吸水性,当它遇到水分子后,能强烈地和水分子结合,生成一系列水合物。这些水合物很稳定,不易分解,所以浓H2SO4是一种很好的干燥剂,能吸收多种气体中的水蒸气,实验室常用来干燥酸性或中性气体。如:CO2,SO2,H2,O2可用浓H2SO4干燥,但碱性气体如:NH3不能用浓H2SO4来干燥。
为什么浓H2SO4能用铁槽来运输:
当铁在常温下和浓H2SO4接触时,它的表面能生成一层致密的氧化膜,这层氧化膜能阻止浓H2SO4;对铁的进一步腐蚀,这种现象叫钝化。
活泼金属能置换出浓H2SO4中的氢吗?
稀H2SO4具有酸的通性,活泼金属能置换出酸中的氢。而浓H2SO4和稀H2SO4的性质不同,活泼金属与浓H2SO4反应时,不能生成氢气,只能生成水和其他物质,因为它具有强氧化性。
敞口放置的浓硫酸.浓盐酸.浓硝酸的变化:
| 酸的名称 | |||||
| 浓盐酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硫酸 | 挥发性 | 变小 | 不变 | 变小 | 变小 |
| 浓硝酸 | 吸水性 | 不变 | 变大 | 变大 | 变小 |
胃酸:
在人的胃液里,HCl的溶质质最分数为0.45%— 0.6%,胃酸是由胃底腺的壁细胞分泌的。它具有以下功能:
(1)促进胃蛋白酶的催化作用,使蛋白质在人体内容易被消化,吸收;(2)使二糖类物质如蔗糖、麦芽糖水解;(3)杀菌。
酸的分类和命名
1.酸根据组成中是否含氧元素可以分为含氧酸和无氧酸。如:盐酸(HCl)属于无氧酸,硫酸(H2SO4)、硝酸(HNO3)属于含氧酸。
2.酸还可以根据每个酸分子电离出的H+个数,分为一元酸、二元酸、多元酸。如:每分子盐酸、硝酸溶于水时能电离出一个H+,属于一元酸;每分子硫酸溶于水时能电离出两个H+,属于二元酸。
3.无氧酸一般从前往后读作“氢某酸”。如:HCl读作氢氯酸(盐酸是其俗名),H2S读作氢硫酸。
4.含氧酸命名时一般去掉氢、氧两种元素,读作 “某”酸。如:H2SO4命名时去掉氢、氧两种元素,读作硫酸,H3PO4读作磷酸。若同一种元素有可变价态,一般低价叫“亚某酸”。如:H2SO3读作亚硫酸,HNO2读作亚硝酸。
发现相似题
与“根据物质的特征对物质进行分类是我们学习和研究化学时常用的...”考查相似的试题有:
- 对生活中的一些现象解释不正确的是( )A.厨房中没有抽油烟机,炒菜时房间内会闻到很大的油烟味,是因为分子在不断运动B.某...
- 决定元素种类的是( )A.质子数B.电子数C.中子数D.核外电子数
- 2008年北京奥运会的理念是“绿色奥运、科技奥运、人文奥运”,在激动人心的体育世界中,处处充满这化学知识.请回答:(1)自第...
- 高铁酸钾(K2FeO4)是紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种新型、高效的多功能水处理剂.干燥的高铁酸钾...
- 如图所示的物质用途中,主要用其物理性质的是( ) A B C DA.活性炭吸附有害气体B.熟石灰改良酸性土壤C.氧气用于气割D.一...
- 生活中的下列变化属于化学变化的是A.果汁榨取B.粉笔折断C.纸张燃烧D.矿石粉碎
- 为除去物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是 ( ) 物质选用试剂操作方法ACu(CuO)氧气通入氧气并加...
- 某化学兴趣小组在做铁与硫酸铜溶液反应时,发现生成铜的同时也有少量气泡产生,为了进一步研究做了如下实验:(1)取8.5g铁粉...
- 下列化学知识在工农业生产、日常生活中的运用,错误的是( )A.用稀盐酸除铁锈B.冰箱内放置活性炭除异味C.用火碱改良酸性...
- 向盛有4.9g20%的硫酸中,慢慢滴加10g20%的Ba(OH)2溶液,能正确表示其变化图像是[ ]A.B.C.D.