本试题 “现有①甲烷②活性炭③一氧化碳④熟石灰四种物质,请按要求用序号填空:(1)可用于改良酸性土壤的是______;(2)可用于消除异味的是______;(3)可用于冶炼金属...” 主要考查您对乙醇
一氧化碳的性质和用途
碳的性质
碱的性质
碱的用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 乙醇
- 一氧化碳的性质和用途
- 碳的性质
- 碱的性质
- 碱的用途
定义:
乙醇的结构简式为C2H5OH,俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。乙醇的用途很广,可用乙醇来制造醋酸、饮料、香精、染料、燃料等。医疗上也常用体积分数为70%——75%的乙醇作消毒剂等。
性状:无色透明液体(纯酒精),有特殊香味的气味,易挥发。能与水、氯仿、乙醚、甲醇、丙酮和其他多数有机溶剂混溶,相对密度(d15.56)0.816,易燃,蒸气能与空气形成爆炸性混合物。
危险特征:本品易燃,其蒸气与空气可形成爆炸性混合物。遇明火、高热能引起燃烧爆炸。与氧化剂接触发生化学反应或引起燃烧。在火场中,受热的容器有爆炸的危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
乙醇的性质:
1. 物理性质:性状无色透明、易燃易挥发液体。有酒的气味和刺激性辛辣味。
熔点-117.3℃
沸点78.32℃
相对密度0.7893
闪点14℃
溶解性溶于水、甲醇、乙醚和氯仿。能溶解许多有机化合物和若干无机化合物。
2. 化学性质:
氧化反应
(1)燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
不完全燃烧:2C2H5OH+5O2 2CO2+2CO+6H2O
2CO2+2CO+6H2O
安全措施:
泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄露:用砂土或其它不燃材料吸附或吸收。也可用大量水冲洗,洗水稀释后放入废水系统。
大量泄露:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
灭火方法:
燃烧性:极易燃
灭火剂:抗溶性泡沫、干粉、二氧化碳、砂土。
灭火注意事项:尽可能将容器从火场移至空旷处。喷水保持容器冷却,直至灭火结束。
紧急处理:
吸入:迅速脱离现场至新鲜空气,若现象严重要尽快就医。
误食:饮足量温水,催吐。若现象严重要尽快就医。
皮肤接触:脱去被污染衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。若现象严重要尽快就医。
实验室使用及灭火
(1)应使用火柴点燃,否则容易使酒精灯内的酒精燃烧。
(2)使用完毕后,应用灯帽将火盖灭。
(3)如不慎将酒精洒出并引燃,则应用湿抹布将其盖灭。
乙醇的用途:
溶剂;有机合成;各种化合物的结晶;洗涤剂;萃取剂;食用酒精可以勾兑白酒;用作粘合剂;硝基喷漆;清漆、化妆品、油墨、脱漆剂等的溶剂以及农药、医药、橡胶、塑料、人造纤维、洗涤剂等的制造原料、还可以做防冻剂、燃料、消毒剂等。 75%(体积分数)的乙醇溶液常用于医疗消毒。
乙醇和甲醇的区别:
①甲醇是甲烷的一个氢原子被羟基(一个氢和一个氧组成的原子团,不是氢氧根)替换后的产物。
乙醇是乙烷一个氢原子被羟基替换后的产物,俗称酒精。
②分子式不一样。
甲醇:CH3OH
乙醇:CH3CH2OH
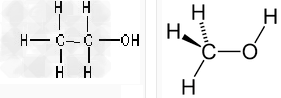
乙醇结构 甲醇结构
他们的分子式不一样,化学性质和物理性质也有区别。
③工业酒精里常含有甲醇,甲醇有毒,不能用工业酒精配制酒
乙醇汽油:
乙醇汽油也被称为(E型汽油),我国使用乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成。它可以改善油品的性能和质量,降低一氧化碳、碳氢化合物等主要污染物排放。
乙醇的结构简式为C2H5OH,俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。乙醇的用途很广,可用乙醇来制造醋酸、饮料、香精、染料、燃料等。医疗上也常用体积分数为70%——75%的乙醇作消毒剂等。
性状:无色透明液体(纯酒精),有特殊香味的气味,易挥发。能与水、氯仿、乙醚、甲醇、丙酮和其他多数有机溶剂混溶,相对密度(d15.56)0.816,易燃,蒸气能与空气形成爆炸性混合物。
危险特征:本品易燃,其蒸气与空气可形成爆炸性混合物。遇明火、高热能引起燃烧爆炸。与氧化剂接触发生化学反应或引起燃烧。在火场中,受热的容器有爆炸的危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
乙醇的性质:
1. 物理性质:性状无色透明、易燃易挥发液体。有酒的气味和刺激性辛辣味。
熔点-117.3℃
沸点78.32℃
相对密度0.7893
闪点14℃
溶解性溶于水、甲醇、乙醚和氯仿。能溶解许多有机化合物和若干无机化合物。
2. 化学性质:
氧化反应
(1)燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O 不完全燃烧:2C2H5OH+5O2
 2CO2+2CO+6H2O
2CO2+2CO+6H2O安全措施:
泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄露:用砂土或其它不燃材料吸附或吸收。也可用大量水冲洗,洗水稀释后放入废水系统。
大量泄露:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
灭火方法:
燃烧性:极易燃
灭火剂:抗溶性泡沫、干粉、二氧化碳、砂土。
灭火注意事项:尽可能将容器从火场移至空旷处。喷水保持容器冷却,直至灭火结束。
紧急处理:
吸入:迅速脱离现场至新鲜空气,若现象严重要尽快就医。
误食:饮足量温水,催吐。若现象严重要尽快就医。
皮肤接触:脱去被污染衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。若现象严重要尽快就医。
实验室使用及灭火
(1)应使用火柴点燃,否则容易使酒精灯内的酒精燃烧。
(2)使用完毕后,应用灯帽将火盖灭。
(3)如不慎将酒精洒出并引燃,则应用湿抹布将其盖灭。
乙醇的用途:
溶剂;有机合成;各种化合物的结晶;洗涤剂;萃取剂;食用酒精可以勾兑白酒;用作粘合剂;硝基喷漆;清漆、化妆品、油墨、脱漆剂等的溶剂以及农药、医药、橡胶、塑料、人造纤维、洗涤剂等的制造原料、还可以做防冻剂、燃料、消毒剂等。 75%(体积分数)的乙醇溶液常用于医疗消毒。
乙醇和甲醇的区别:
①甲醇是甲烷的一个氢原子被羟基(一个氢和一个氧组成的原子团,不是氢氧根)替换后的产物。
乙醇是乙烷一个氢原子被羟基替换后的产物,俗称酒精。
②分子式不一样。
甲醇:CH3OH
乙醇:CH3CH2OH

乙醇结构 甲醇结构
他们的分子式不一样,化学性质和物理性质也有区别。
③工业酒精里常含有甲醇,甲醇有毒,不能用工业酒精配制酒
乙醇汽油:
乙醇汽油也被称为(E型汽油),我国使用乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成。它可以改善油品的性能和质量,降低一氧化碳、碳氢化合物等主要污染物排放。
概述:
一氧化碳(CO)纯品为无色、无臭、无刺激性的气体。分子量28.01,密度1.250g/l,冰点为-207℃,沸点-190℃。在水中的溶解度甚低。空气混合爆炸极限为12.5%~74%。一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。因此一氧化碳具有毒性。一氧化碳是无色、无臭、无味的气体,故易于忽略而致中毒。常见于家庭居室通风差的情况下,煤炉产生的煤气或液化气管道漏气或工业生产煤气以及矿井中的一氧化碳吸入而致中毒。
物理性质:
通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
化学性质:
(1)可燃性:2CO + O2 2CO2
2CO2
(2)还原性:
一氧化碳还原氧化铜:CO+ CuO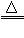 Cu + CO2
Cu + CO2
一氧化碳还原氧化铁:3CO+ Fe2O3 2Fe + 3CO2
2Fe + 3CO2
一氧化碳还原四氧化三铁:4CO+ Fe3O4 3Fe + 4CO2
3Fe + 4CO2
(3)毒性:
CO极易和血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时危及生命。CO有剧毒,人在CO的体积分数达到 0.02%的空气中持续停留2—3h即出现中毒症状,因此我们使用煤、燃气热水器时要装烟囱,注意室内通风。
用途:
用作燃料,冶炼金属。
一氧化碳和氢气的比较
H2、CO、C的比较
注意:
(1)三种物质燃烧的现象有所不同,但不能根据火焰去鉴别CO和H2
(2)在还原CuO的实验中,必须对多余的CO进行处理
一氧化碳(CO)纯品为无色、无臭、无刺激性的气体。分子量28.01,密度1.250g/l,冰点为-207℃,沸点-190℃。在水中的溶解度甚低。空气混合爆炸极限为12.5%~74%。一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。因此一氧化碳具有毒性。一氧化碳是无色、无臭、无味的气体,故易于忽略而致中毒。常见于家庭居室通风差的情况下,煤炉产生的煤气或液化气管道漏气或工业生产煤气以及矿井中的一氧化碳吸入而致中毒。
物理性质:
通常状况下,是一种没有颜色,气味的气体,比空气略轻难溶于水。
化学性质:
(1)可燃性:2CO + O2
 2CO2
2CO2 (2)还原性:
一氧化碳还原氧化铜:CO+ CuO
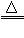 Cu + CO2
Cu + CO2 一氧化碳还原氧化铁:3CO+ Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 一氧化碳还原四氧化三铁:4CO+ Fe3O4
 3Fe + 4CO2
3Fe + 4CO2 (3)毒性:
CO极易和血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时危及生命。CO有剧毒,人在CO的体积分数达到 0.02%的空气中持续停留2—3h即出现中毒症状,因此我们使用煤、燃气热水器时要装烟囱,注意室内通风。
用途:
用作燃料,冶炼金属。
一氧化碳和氢气的比较
| 颜色状态 | 无色,无味气体 | 无色,无味气体 |
| 密度 | 1.250g/l(略小于空气) | 0.089g/l(最轻的气体) |
| 可燃性 | 有可燃性 2CO+O2  2CO2 2CO2 |
有可燃性 2H2+O2  2H2O 2H2O |
| 还原性 | 有还原性 CO+CuO 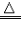 Cu+CO2 Cu+CO2 |
有还原性 H2+CuO  Cu+H2O Cu+H2O |
| 毒性 | 剧毒 | 无毒 |
| 鉴别方法 | 根据燃烧产物的不同鉴别 | |
H2、CO、C的比较
| H2 | C | CO | ||
| 可燃性 | 化学方程式 | 2H2+O2 2H2O 2H2O |
C+O2 CO2; CO2;2C+O2  2CO 2CO |
2CO+O2 2CO2 2CO2 |
| 反应现象 | 淡蓝色火焰,放热,生成 无色液体 |
发光,放热 | 蓝色火焰,放热, 生成的无色气体 能使澄清石灰水 变浑浊 | |
| 还原性 | 方程式 | 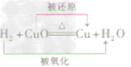 |
 |
 |
| 反应现象 | 黑色固体变红,生成无色液体,管口有水珠 | 黑色固体变红,生成的无色气体能使澄清石灰水变洪浑浊 | 黑色固体变红,生成的无色气体能使澄清石灰水变浑浊 | |
| 装置图 |  |
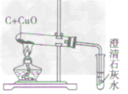 |
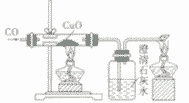 | |
| 装置要点 | 试管口略向下倾斜,导管贴试管上臂至药品上方,试管口没有橡皮塞 | 试管口略向下倾斜,导管刚过橡皮塞 | 多余的CO要进行尾气处理(如点燃) | |
| 主要步骤 | 通H2→加热→停止加热→停止通H2 | 反应结束后,先将导管从液体中取出,再停止加热 | 通CO→加热→停止加热→停止通CO | |
| 优点 | 反应条件低,生成物是水,不污染环境 | 原料便宜,操作简便 | 反应条件低 | |
| 缺点 | 不安全,操作复杂 | 反应条件高,生成物不易提纯 | 不安全,操作复杂,有毒 | |
| 用途 | 作工业原料,作高能燃料,冶炼金属 | 作燃料,冶炼金属, | 作燃料,冶炼金属, | |
(1)三种物质燃烧的现象有所不同,但不能根据火焰去鉴别CO和H2
(2)在还原CuO的实验中,必须对多余的CO进行处理
概述:
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2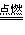 CO2
CO2
氧气不充分的条件下:2C+O2 2CO
2CO
3.还原性:
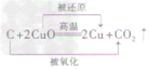
木炭还原氧化铜:C+2CuO 2Cu+CO2↑
2Cu+CO2↑
焦炭还原氧化铁:3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
焦炭还原四氧化三铁:2C+Fe3O4 3Fe+2CO2↑
3Fe+2CO2↑
木炭与二氧化碳的反应:C+CO2 CO
CO
碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2 CO2
CO2
氧气量不充足时,碳不充分燃烧:2C+O2 2CO
2CO
mg碳与ng氧气反应:
①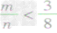 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;
②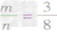 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2;
③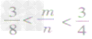 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;
④ 时,恰好完全反应生成CO;
时,恰好完全反应生成CO;
⑤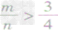 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。
碳单质及其化合物间的转化:
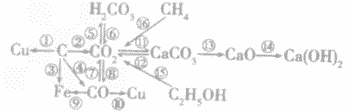
(1)C+2CuO 2Cu+CO2↑
2Cu+CO2↑
(2)C+O2 CO2
CO2
(3)3C+2Fe2O3 4Fe+3CO2↑
4Fe+3CO2↑
(4)2C+O2 2CO
2CO
(5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2 2CO2
2CO2
(8)C+CO2 2CO
2CO
(9)3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
(10)CO+ 2CuO 2Cu + CO2
2Cu + CO2
(11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3 CaO+CO2
CaO+CO2
(14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
(16)CH4+O2 CO2+2H2O
CO2+2H2O
碳是一种非金属元素,位于元素周期表的第二周期IVA族。拉丁语为Carbonium,意为“煤,木炭”。汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。碳是生铁、熟铁和钢的成分之一。碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。生物体内大多数分子都含有碳元素。
碳的存在形式:
碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:
1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应
2.可燃性:
氧气充足的条件下:C+O2
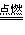 CO2
CO2 氧气不充分的条件下:2C+O2
 2CO
2CO 3.还原性:
木炭还原氧化铜:C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O4
 3Fe+2CO2↑
3Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2
 CO
CO 碳”与“炭”的区别:
“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:
氧气量充足时,碳充分燃烧:C+O2
 CO2
CO2 氧气量不充足时,碳不充分燃烧:2C+O2
 2CO
2CO mg碳与ng氧气反应:
①
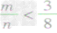 时,生成物只有CO,且O2有剩余;
时,生成物只有CO,且O2有剩余;②
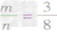 时,恰好完全反应生成CO2;
时,恰好完全反应生成CO2; ③
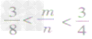 时,生成物既有CO2,也有CO;
时,生成物既有CO2,也有CO;④
 时,恰好完全反应生成CO;
时,恰好完全反应生成CO; ⑤
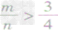 时,生成物只有CO,且C有剩余。
时,生成物只有CO,且C有剩余。 碳单质及其化合物间的转化:

(1)C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ (2)C+O2
 CO2
CO2(3)3C+2Fe2O3
 4Fe+3CO2↑
4Fe+3CO2↑ (4)2C+O2
 2CO
2CO (5)CO2 + H2O===H2CO3
(6)H2CO3==CO2 + H2O
(7)2CO + O2
 2CO2
2CO2 (8)C+CO2
 2CO
2CO(9)3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 (10)CO+ 2CuO
 2Cu + CO2
2Cu + CO2 (11)Ca(OH)2 + CO2====CaCO3↓+ H2O
(12)CaCO3+2HCl==CaCl2+CO2↑+H2O
(13)CaCO3
 CaO+CO2
CaO+CO2 (14)CaO+H2O==Ca(OH)2
(15)C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O(16)CH4+O2
 CO2+2H2O
CO2+2H2O碱的定义:
碱是指在溶液中电离成的阴离子全部是OH-的化合物。碱由金属离子(或铵根离子)和氢氧根离子构成,可用通式R(OH)n表示。从元素组成来看,碱一定含有氢元素和氧元素。
常见的碱:
(1)氢氧化钠、氢氧化钙都属于碱。除这两种碱外,常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)、治疗胃酸过多的药物中的氢氧化铝[Al(OH)3)。
(2)晶体(固体)吸收空气里的水分.表而潮湿而逐步溶解的现象叫做潮解。氢氧化钠、粗盐、氯化镁等物质都易潮解,应保存在密闭干燥的地方。同时称量 NaOH固体时要放在玻璃器皿中,不能放在纸上,防止 NaOH固体潮解后腐蚀天平的托盘。
(3)熟石灰可由生石灰(CaO)与水反应制得,反应的化学方程式为:CaO+H2O==Ca(OH)2,反应时放出大量的热。
碱的通性
常见的碱有NaOH、KOH、Ca(OH)2、氨水的特性:
①氢氧化钠(NaOH)俗名苛性钠、火碱、烧碱,这是因为它有强腐蚀性。NaOH是一种可溶性强碱。白色固体,极易溶于水,暴露在空气中易潮解,可用作碱性气体(如NH3)或中性气体(如H2、O2、CO等)的干燥剂。NaOH易与空气中的CO2反应生成Na2CO3固体。NaOH溶液可以腐蚀玻璃,盛NaOH溶液的试剂瓶不能用磨口的玻璃塞,只能用橡胶塞。
②氢氧化钙[Ca(OH)2]是白色粉末,微溶于水,俗称熟石灰或消石灰,其水溶液称为石灰水。Ca(OH)2也有腐蚀作用。Ca(OH)2与CO2反应生成白色沉淀CaCO3,常用于检验CO2。 Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2能跟Na2CO3反应生成NaOH,用于制取NaOH。反应方程式为: Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③氨水(NH3·H2O)是一种可溶性弱碱,NH3溶于水可得氨水。有刺激性气味,有挥发性。将氨气通过盛放氧化铜的玻璃管,生成氮气、水和铜,其反应方程式为: 2NH3+3CuO=(加热)=3Cu+N2↑+3H2O,说明氨气具有还原性。
此外,KOH、Ba(OH)2也是常见的可溶性强碱。不溶的碱大多是弱碱,如:Fe(OH)3、Cu(OH)2等。他们的共同性质是热稳定性差,受热易分解生成对应的金属氧化物和水。
氢氧化钠、氢氧化钙的物理性质和用途比较
氢氧化钠、氢氧化钙化学性质的比较
几种碱的颜色和溶解度
概念性质的理解
①氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沽到皮肤.上或洒在衣服上。如果不慎将碱液沽到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
②浓硫酸、氢氧化钠固体溶于水放热,属于物理变化;而氧化钙溶于水放热是氧化钙与水反应放出大量的热,属于化学变化;生石灰具有强烈的吸水性,可以作某些气体的干燥剂。
③由于NaOH易潮解,同时吸收空气中的CO2发生变质,所以NaOH必须密封保存。
④保存碱溶液的试剂瓶应用橡胶塞、不能用玻璃塞,以防止长期不用碱溶液,碱溶液腐蚀玻璃造成打不开的情况。
⑤只有可溶性碱溶液才能使指示剂变色,如NaOH溶液能使无色酚酞变红;但不溶性碱不能使指示剂变色,如Mg(OH)2中滴加无色酚酞,酚酞不变色。
⑥盐和碱的反应,反应物中的盐和碱必须溶于水,生成物中至少有一种难溶物、气体或H2O。铵盐与碱反应生成的碱不稳定,分解为NH3和H2O。
⑦碱与酸的反应中碱可以是不溶性碱,如 Cu(OH)2+H2SO4==CuSO4+2H2O。
氢氧化钠和氢氧化钙的鉴别:
NaOH与Ca(OH)2的水溶液都能使酚酞变红,故鉴别NaOH和Ca(OH)2不能用指示剂,通常情况下,可采用以下两种方法来鉴别NaOH和Ca(OH)2
方法一:通入CO2气体,NaOH溶液与CO2气体反应后无明显现象,但Ca(OH)2溶液即澄清石灰水与 CO2反应生成白色沉淀。
方法二:滴加Na2CO3溶液或K2CO3溶液,NaOH溶液与K2CO3,Na2CO3溶液不反应,但Ca(OH)2溶液与 Na2CO3、K2CO3溶液反应均生成白色沉淀。Ca(OH)2+ Na2CO3==CaCO3↓+2NaOH,Ca(OH)2+K2CO3 ==Na2CO3+2KOH。
检验二氧化碳气体是否与氢氧化钠溶液反应的方法
通常情况下,将二氧化碳气体直接通人装有氢氧化钠溶液的试管中,很难直接判断二氧化碳气体是否与氢氧化钠溶液反应。因此,要判断二氧化碳气体确实能与氢氧化钠反应,可以采取如下两种方法:
(1)检验产物的方法:验证通入二氧化碳气体后的溶液中是否含有碳酸钠,检验碳酸根离子是否存在。通常检验碳酸根离子的方法是:
方法1:取样,加入稀盐酸,并将产生的气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明溶液中存在碳酸根离子。
方法2:取样,加入氢氧化钙溶液,若产生白色沉淀,则证明溶液中存在碳酸根离子。上述两种方法其实也可以检验氢氧化钠溶液是否变质.而且方法I还可以用于除去变质后的氢氧化钠溶液中的碳酸钠。
(2)改进实验装置,通过一些明显的实验现象间接证明二氧化碳气体能与氢氧化钠反应。如:
碱的命名:
一般读作氢氧化某,如:NaOH读作氢氧化钠。变价金属元素形成的碱,高价金属碱读作氢氧化某,如Fe(OH)3读作氢氧化铁,低价金属碱读作氢氧化亚某,如Fe(OH)2读作氢氧化亚铁。
氨水:
氨气的水溶液俗称氨水,主要成分是NH3·H2O,通常状况下是无色液体,具有挥发性。浓氨水能挥发出具有刺激性气味的氨气NH3。
氨水显碱性,能使指示剂变色。
氨水的组成中含有N元素,因此可通过与酸反应生成铵盐来制氮肥,其本身也是一种氮肥。在化学实验中一般可用浓氨水做分子运动的探究实验。
碱是指在溶液中电离成的阴离子全部是OH-的化合物。碱由金属离子(或铵根离子)和氢氧根离子构成,可用通式R(OH)n表示。从元素组成来看,碱一定含有氢元素和氧元素。
常见的碱:
(1)氢氧化钠、氢氧化钙都属于碱。除这两种碱外,常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)、治疗胃酸过多的药物中的氢氧化铝[Al(OH)3)。
(2)晶体(固体)吸收空气里的水分.表而潮湿而逐步溶解的现象叫做潮解。氢氧化钠、粗盐、氯化镁等物质都易潮解,应保存在密闭干燥的地方。同时称量 NaOH固体时要放在玻璃器皿中,不能放在纸上,防止 NaOH固体潮解后腐蚀天平的托盘。
(3)熟石灰可由生石灰(CaO)与水反应制得,反应的化学方程式为:CaO+H2O==Ca(OH)2,反应时放出大量的热。
碱的通性
| 碱的通性 | 反应规律 | 化学方程式 | 反应类型 |
| 碱溶液与指示剂的反应 | 碱溶液能使紫色石蕊试液变蓝,无色酚酞试液变红 | —— | —— |
| 碱与非金属氧化物反应 | 碱+非金属氧化物→盐+水 | 2NaOH+CO2==Na2CO3+H2O Ca(OH)2+CO2==CaCO3↓+H2O |
—— |
| 碱与酸反应 | 碱+酸→盐+水 | NaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O |
复分解反应 |
| 碱与某些盐反应 | 碱1+盐1→碱2+盐2 | 2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 Ca(OH)2+Na2CO3==CaCO3↓+2NaOH |
复分解反应 |
| 碱+铵盐→氨气+水+盐 | NH4Cl+NaOH NaCl+NH3↑+H2O NaCl+NH3↑+H2O |
复分解反应 |
常见的碱有NaOH、KOH、Ca(OH)2、氨水的特性:
①氢氧化钠(NaOH)俗名苛性钠、火碱、烧碱,这是因为它有强腐蚀性。NaOH是一种可溶性强碱。白色固体,极易溶于水,暴露在空气中易潮解,可用作碱性气体(如NH3)或中性气体(如H2、O2、CO等)的干燥剂。NaOH易与空气中的CO2反应生成Na2CO3固体。NaOH溶液可以腐蚀玻璃,盛NaOH溶液的试剂瓶不能用磨口的玻璃塞,只能用橡胶塞。
②氢氧化钙[Ca(OH)2]是白色粉末,微溶于水,俗称熟石灰或消石灰,其水溶液称为石灰水。Ca(OH)2也有腐蚀作用。Ca(OH)2与CO2反应生成白色沉淀CaCO3,常用于检验CO2。 Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2能跟Na2CO3反应生成NaOH,用于制取NaOH。反应方程式为: Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③氨水(NH3·H2O)是一种可溶性弱碱,NH3溶于水可得氨水。有刺激性气味,有挥发性。将氨气通过盛放氧化铜的玻璃管,生成氮气、水和铜,其反应方程式为: 2NH3+3CuO=(加热)=3Cu+N2↑+3H2O,说明氨气具有还原性。
此外,KOH、Ba(OH)2也是常见的可溶性强碱。不溶的碱大多是弱碱,如:Fe(OH)3、Cu(OH)2等。他们的共同性质是热稳定性差,受热易分解生成对应的金属氧化物和水。
氢氧化钠、氢氧化钙的物理性质和用途比较
| 俗名 | 苛性钠,火碱,烧碱 | 熟石灰,消石灰 |
| 颜色、状态 | 白色,片状固体 | 白色,粉末状固体 |
| 腐蚀性 | 强烈腐蚀性 | 较强腐蚀性 |
| 溶解性 | 易溶于水,易潮解,溶解时放热 | 微溶于水,其水溶液俗称石灰水 |
| 用途 | 化工原料,用于肥皂、石油、纺织、印染工业等;生活中用于除油污 | 用于建筑工业,制漂自粉,改良土壤,配制农药等 |
氢氧化钠、氢氧化钙化学性质的比较
| 氢氧化钠 | 氢氧化钙 |
| 跟指示剂作用.使紫色石蕊试液变成蓝色,使无色酚酞试液变成红色 | 跟指示剂作用,使紫色石蕊试液变成蓝色,使无色酚酞试液变成红色 |
| 跟某些非金属氧化物反应 2NaOH+CO2==Na2CO3+H2O 2NaOH+SO2==Na2SO3+H2O 2NaOH+SO3==Na2SO4+H2O |
跟某些非金属氧化物反应 Ca(OH)2+CO2==CaCO3↓+H2O Ca(OH)2+SO2==CaSO3↓+H2O Ca(OH)2+SO3==CaSO4+H2O |
| 跟酸发生中和反应 2NaOH+H2SO4==Na2SO4+2H2O |
跟酸发生中和反应 Ca(OH)2+H2SO4==CaSO4+2H2O |
| 跟某些盐反应 2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 |
跟某些盐反应 Ca(OH)2+Na2CO3==CaCO3↓+2NaOH |
几种碱的颜色和溶解度
| 碱 | 颜色 | 溶解性 |
| NaOH、KOH、Ba(OH)2 | 白色 | 易溶 |
| Ca(OH)2 | 白色 | 微溶 |
| Mg(OH)2、Al(OH )3、Fe(OH )2 | 白色 | 难溶 |
| Fe(OH )3 | 红褐色 | 难溶 |
| Cu(OH)2 | 蓝色 | 难溶 |
概念性质的理解
①氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沽到皮肤.上或洒在衣服上。如果不慎将碱液沽到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
②浓硫酸、氢氧化钠固体溶于水放热,属于物理变化;而氧化钙溶于水放热是氧化钙与水反应放出大量的热,属于化学变化;生石灰具有强烈的吸水性,可以作某些气体的干燥剂。
③由于NaOH易潮解,同时吸收空气中的CO2发生变质,所以NaOH必须密封保存。
④保存碱溶液的试剂瓶应用橡胶塞、不能用玻璃塞,以防止长期不用碱溶液,碱溶液腐蚀玻璃造成打不开的情况。
⑤只有可溶性碱溶液才能使指示剂变色,如NaOH溶液能使无色酚酞变红;但不溶性碱不能使指示剂变色,如Mg(OH)2中滴加无色酚酞,酚酞不变色。
⑥盐和碱的反应,反应物中的盐和碱必须溶于水,生成物中至少有一种难溶物、气体或H2O。铵盐与碱反应生成的碱不稳定,分解为NH3和H2O。
⑦碱与酸的反应中碱可以是不溶性碱,如 Cu(OH)2+H2SO4==CuSO4+2H2O。
氢氧化钠和氢氧化钙的鉴别:
NaOH与Ca(OH)2的水溶液都能使酚酞变红,故鉴别NaOH和Ca(OH)2不能用指示剂,通常情况下,可采用以下两种方法来鉴别NaOH和Ca(OH)2
方法一:通入CO2气体,NaOH溶液与CO2气体反应后无明显现象,但Ca(OH)2溶液即澄清石灰水与 CO2反应生成白色沉淀。
方法二:滴加Na2CO3溶液或K2CO3溶液,NaOH溶液与K2CO3,Na2CO3溶液不反应,但Ca(OH)2溶液与 Na2CO3、K2CO3溶液反应均生成白色沉淀。Ca(OH)2+ Na2CO3==CaCO3↓+2NaOH,Ca(OH)2+K2CO3 ==Na2CO3+2KOH。
检验二氧化碳气体是否与氢氧化钠溶液反应的方法
通常情况下,将二氧化碳气体直接通人装有氢氧化钠溶液的试管中,很难直接判断二氧化碳气体是否与氢氧化钠溶液反应。因此,要判断二氧化碳气体确实能与氢氧化钠反应,可以采取如下两种方法:
(1)检验产物的方法:验证通入二氧化碳气体后的溶液中是否含有碳酸钠,检验碳酸根离子是否存在。通常检验碳酸根离子的方法是:
方法1:取样,加入稀盐酸,并将产生的气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明溶液中存在碳酸根离子。
方法2:取样,加入氢氧化钙溶液,若产生白色沉淀,则证明溶液中存在碳酸根离子。上述两种方法其实也可以检验氢氧化钠溶液是否变质.而且方法I还可以用于除去变质后的氢氧化钠溶液中的碳酸钠。
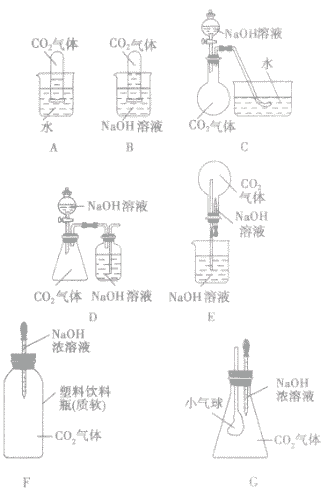
(2)改进实验装置,通过一些明显的实验现象间接证明二氧化碳气体能与氢氧化钠反应。如:

| 所选装置 | 操作方法 | 实验现象 |
| A | 将充满二氧化碳的试管倒扣在水中 | 试管内的液面略有上升 |
| B | 将充满二氧化碳的试管倒扣在氢氧化钠溶液中 | 试管内的液面明显上升 |
| C | 将氢氧化钠溶液滴入烧瓶 | 水槽中的水倒吸入烧瓶内 |
| D | 将氢氧化钠溶液滴入锥形瓶 | 集气瓶中,NaOH溶液中的长导管下端产生气泡 |
| E | 将胶头滴管中氢氧化钠溶液挤入烧瓶 | 烧瓶内产生“喷泉” 现象 |
| F | 将胶头滴管中的氢氧化钠溶液挤入软塑料瓶 | 塑料瓶变瘪 |
| G | 将胶头滴管中的氢氧化钠溶液挤入锥形瓶中 | 小气球胀大 |
碱的命名:
一般读作氢氧化某,如:NaOH读作氢氧化钠。变价金属元素形成的碱,高价金属碱读作氢氧化某,如Fe(OH)3读作氢氧化铁,低价金属碱读作氢氧化亚某,如Fe(OH)2读作氢氧化亚铁。
氨水:
氨气的水溶液俗称氨水,主要成分是NH3·H2O,通常状况下是无色液体,具有挥发性。浓氨水能挥发出具有刺激性气味的氨气NH3。
氨水显碱性,能使指示剂变色。
氨水的组成中含有N元素,因此可通过与酸反应生成铵盐来制氮肥,其本身也是一种氮肥。在化学实验中一般可用浓氨水做分子运动的探究实验。
常见的碱的用途:
1. 氢氧化钠:是重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业。实验室中可作干燥剂。
2. 氢氧化钙:用于建筑业,制漂白粉,改良土壤。常用于实验室二氧化碳的检验。
1. 氢氧化钠:是重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业。实验室中可作干燥剂。
2. 氢氧化钙:用于建筑业,制漂白粉,改良土壤。常用于实验室二氧化碳的检验。
发现相似题
与“现有①甲烷②活性炭③一氧化碳④熟石灰四种物质,请按要求用序号...”考查相似的试题有:
- 人们使用煤、石油等化石燃料,对环境造成的污染:一是 ,二是 ,使用煤气、天然气比使用煤、石油对大气污染 。
- 在甲烷、氢气、稀盐酸、一氧化碳、金刚石、烧碱等物质中,可作为未来理想能源的是______,属于混合物的是______,自然界最硬...
- 甲同学用一氧化碳还原铁的氧化物,取不同质量的铁的氧化物进行实验,所得到的数据如下表所示:实验序号铁的氧化物质量/g生成...
- 有a、b、c、d四支容积相同且密封的试管,分别充满氢气、氧气、二氧化碳、一氧化碳四种气体,将它们分别倒立于装有水的水槽中...
- 只用C、CO、CuO、CaCO3、稀盐酸五种物质,进行单一或两两反应,可写出生成物中有CO2的化学方程式的个数为[ ]A.2个B.3个C.4...
- 金刚石和石墨都是由碳元素所形成的不同单质,但它们的物理性质差异较大,原因是______;它们的化学性质相似,原因是______;C...
- 从“物质性质⇔物质用途”这一角度分析木炭粉的有关知识:从物理性质分析:______;从化学性质分析:______.
- 实验室有两瓶失去标签的无色溶液,只知道它们分别是氢氧化钙溶液和氢氧化钠溶液,请你用化学方法鉴别两种无色溶液. 实验操作...
- 桂林的机场路建设时,使用了大量的氢氧化钙,氢氧化钙的俗称是( )A.石灰水B.生石灰C.熟石灰D.小苏打
- 化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定。甲、乙两同学各提出不同的测定方法:(1)甲同学:酸...