本试题 “化学与生活息息相关.(1)自热米饭是一种快餐食品.请根据图及表信息,回答下列问题:营养素每份含量油脂23.5g糖类104.7g维生素3.5g钠814mg钙130mg水小于210...” 主要考查您对单质铝
合理膳食
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质铝
- 合理膳食
铝的主要性质:
- 物理性质:
铝是银白色,具有金属光泽的固体,硬度较小,具有良好的导电性、导热性和延展性。 - 化学性质:
活泼金属,具有较强的还原性;常温下铝在浓硫酸和浓硝酸中发生钝化;既可以与酸反应又可以与碱反应。
(1)与氧气反应: (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光)
(2)与Cl2 、S 、N2反应: (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)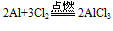
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑)
(3)与水反应: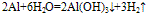
(4)与酸反应: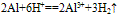
(5)与碱的反应:
(6)铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe - 铝的用途
纯铝制作导线,铝合金用于制造飞机、汽车、生活用品等。
铝的特殊性质:
铝既能与酸反应,也能与强碱反应。
铝与酸反应:铝与浓硫酸在常温下发生钝化,2Al+6HCl==2AlCl3+3H2↑
铝与碱反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑
铝热反应:
铝热法是一种利用铝的还原性获得高熔点金属单质的方法。此种反应被称为铝热反应。
可简单认为是铝与某些金属氧化物(如Fe2O3、Fe3O4、Cr2O3、V2O5等)或非金属氧化物(如SiO2等)在高热条件下发生的反应。
铝热反应常用于冶炼高熔点的金属,并且它是一个放热反应,
其中镁条为引燃剂,氯酸钾为助燃剂。
其装置如下图所示: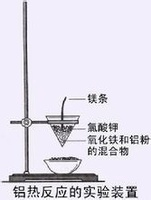
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,然后便可得到Al为8,Fe为9。
镁铝的化学性质比较:
| 单质 | 镁 | 铝 |
| 与非金属反应 | 2Mg+O2=(点燃)=2MgO (发出耀眼白光) Mg+Cl2=(点燃)=MgCl2 3Mg+N2=(点燃)=Mg3N2 |
4Al+3O2=(加热)=2Al2O3 2Al+3Cl2=(加热)=2AlCl3 2Al+3S=(加热)=Al2S3 |
| 与沸水反应 | Mg+2H2O=(加热)=Mg(OH)2+H2↑ | 不反应 |
| 与酸反应 | Mg+2H+==Mg2++H2↑ 与稀硝酸反应生成Mg(NO3)2、NOx(或者N2、NH4NO3)、H2O |
2Al+6H+==2Al3++3H2↑ 在冷的浓硝酸或浓硫酸中钝化 |
| 与氧化物反应 | 2Mg+CO2=(点燃)=2MgO+C (剧烈燃烧,生成白色粉末和黑色固体) |
2Al+Fe2O3=(高温)=2Fe+Al2O3(铝热反应) |
| 与盐溶液反应 | Mg+2NH4++2H2O==Mg2++2NH3·H2O+H2↑ Mg+Cu2+==Mg2++Cu |
2Al+3Hg2+=2Al3++3Hg |
| 与强碱反应 | 不反应 | 2Al+2OH-+2H2O==2AlO2-+3H2↑ |
铝热反应配平技巧:
取反应物和生成物中氧化物中两边氧的最小公倍数,即可快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下便可得到Al为8,Fe为9。
铝与酸、碱反应的计算技巧:
铝与酸、碱反应的实质都是 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: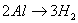 ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。
铝与酸或碱溶液反应生成H2的量的计算:
Al是我们中学阶段学习的唯一既与H+反应也与OH-反应的金属,它与酸、碱反应既有相同点,也有不同点。
相同点:Al均被氧化成+3价,所以1molAl不论与H+还是与OH-反应均生成3gH2。
不同点:1molAl与H+反应消耗3molH+,而与OH-反应只消耗1molOH-,所以含有等物质的量的NaOH溶液和HCl溶液分别与足量的铝反应时生成的氢气的物质的量之比为3∶1。

“铝三角”关系:
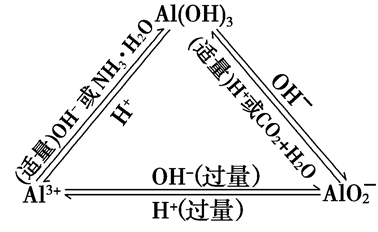
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2-+2H2O
Al3++4OH-===AlO2-+2H2O
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
AlO2-+H++H2O===Al(OH)3↓
AlO2-+4H+===Al3++2H2O
钝化:
铝、铁在常温下与浓硫酸发生钝化,钝化不是不反应,而是被氧化成一层致密的氧化物薄膜,恰恰说明金属的活泼性。
1.食物多样性,以谷类为主
2.多吃蔬菜﹑水果和薯类蔬菜与水果含丰富的维生素、矿物质和膳食纤维。有些水果维生素及一些微量元素的含量不如新鲜蔬菜,但水果含有的葡萄糖、果糖、柠檬酸、苹果酸、果胶等物质又比蔬菜丰富。红黄色水果例如鲜枣、柑橘、柿子和杏等是维生素C和胡萝卜素的丰富来源。薯类含有丰富的淀粉、膳食纤维、多种维生素以及矿物质。
3.常吃奶类﹑豆类或其制品奶类含有丰富的优质蛋白质和维生素,钙含量也较高,并且钙的利用率很高,是天然钙质的极好来源。大量的研究工作表明,给儿童、青少年补钙可以提高其骨密度,从而延缓其发生骨质疏松的年龄;给老年人补钙也可能减缓其骨质丢失的速度。豆类是我国的传统食品,含丰富的优质蛋白质、不饱和脂肪酸、钙以及B族维生素等。
4.经常吃适量鱼、禽、蛋、瘦肉,少吃肥肉和荤油鱼、禽、蛋、瘦肉等动物性食物是优质蛋白质、脂溶性维生素和矿物质的良好来源。动物性蛋白质的氨基酸组成更适合人体需要,且赖氨酸含量较高,有利于补充植物性蛋白质中赖氨酸的不足。肉类中铁的利用较好,鱼类特别是盐水鱼所含不饱和脂肪酸有降低血栓形成的作用。肥肉和荤油为高能量和高脂肪食物,摄入过多往往会引起肥胖,并是某些慢性病的危险因素,应当少吃。
5.食量与体力活动要平衡,保持适宜体重进食量与体力活动是控制体重的两个主要因素。食物提供人体能量,体力活动消耗能量。如果进食量过大而活动量不足,多余的能量就会在体内以脂肪的形式积存既增加体重,久之发胖相反若食量不足,劳动或运动量过大,可由于能量不足引起消瘦,造成运动能力下降。所以人们需要保持食量与能量消耗之间的平衡。三餐分配要合理。一般早、中、晚餐的能量分别占总能量的30%﹑40%﹑30%为宜。
6.吃清淡少盐的膳食
与“化学与生活息息相关.(1)自热米饭是一种快餐食品.请根据图...”考查相似的试题有:
- 对I~IV的实验操作现象判断正确的是A.实验I:产生红褐色沉淀B.实验II:溶液颜色变红C.实验III:放出大量气体D.实验IV:先...
- A~J分别表示中学中常见的物质,它们之间相互关系如下图所示(部分反应物、 生成物没有列出),且已知G为某主族元素的氧化物,...
- 1mol铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的...
- 常温下能用铝制容器盛放的是( )A.稀硫酸B.氢氧化钠溶液C.浓硫酸D.硫酸铜溶液
- 用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否.下列类推结论中正确的是[ ]A.Na失火...
- 有100mL3mol・L-1NaOH溶液和100mL1mol・L-1AlCl3溶液按如下两种方法进行实验:①将NaOH溶液逐渐滴加到AlCl3溶液中;②将AlCl3溶...
- 相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是[ ]A.Al2O3B.Al(OH)3C.AlC13D.Al
- 为测某镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入100mL0.3mol·L—1稀硫酸,合金完全溶解,产生的气体在标准状...
- 下列物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是( )①铁与稀硝酸 ②AlCl3溶液与NaOH溶液 ③碳酸钠溶液与...
- 既能与强酸又能与强碱反应的一组物质是( )①Al ②Al2O3③Al(OH)3④NaHCO3.A.只有①②B.只有②③C.只有①②③D.①②③④均可