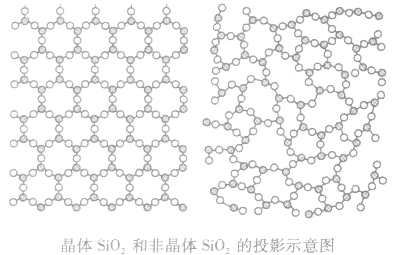
晶体与非晶体:
|
晶体 |
非晶体 |
| 微观结构 |
原子在三维空间里呈周期性有序排列 |
原子排列相对无序 |
| 实例 |
白磷、硫黄、固态碘、高锰酸钾、干冰、金刚石、金属铜等绝大多数常见的固体 |
玻璃、石蜡、沥青等固体 |
| 自范性 |
有(能自发呈现封闭的、规则的多面体外形) |
无 |
| 各向异性 |
有(晶体在不同的方向上表现出不同的物理性质) |
无 |
| 对称性 |
有 |
无 |
| 熔点 |
固定 |
不固定 |
| 鉴别方法 |
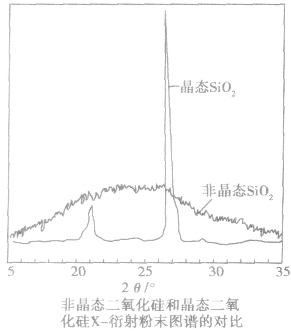
对固体进行X一射线衍射实验。当单一波长的 X一射线通过晶体时,会在记录仪上看到分立的斑点或谱线 |
原子晶体:
相邻原子间以共价键相结合而形成空间网状结构的晶体,熔沸点高,导热性、延展性不良,导电性差,硬度大。如:金刚石、石英。
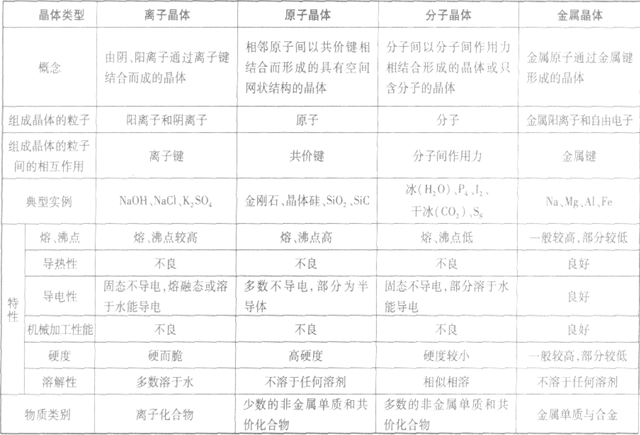
晶体的基本类型与性质:
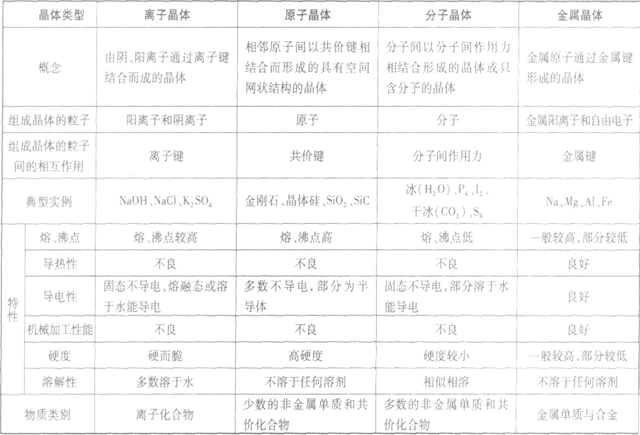
晶体熔、沸点高低的比较规律:
(1)不同类型晶体的熔、沸点高低规律:一般,原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点有的很高,如钨、铂等;有的则很低,如汞、铯等。
(2)同种类型晶体,晶体内粒子间的作用力越大,熔、沸点越高。
①分子晶体:分子间作用力越大,物质的熔、沸点越高,反之越低。
a.组成和结构相似的分子,相对分子质量越大,范德华力越大,熔、沸点越高。如沸点:O2>N2、HI>HBI>HCl(含氢键的除外)。
b.相对分子质量相等或相近的分子,极性分子的范德华力大,熔、沸点高。如沸点:CO>N2。
c.含有氢键的分子熔、沸点比较高。如沸点:H2O >H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
d.在烷烃的同分异构体中,一般来说,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物苯环上的同分异构体熔、沸点大小一般按照“邻位>问位>对位”的顺序。
e.在高级脂肪酸形成的油脂中,油的熔、沸点比脂肪低,烃基部分的不饱和程度越大(碳碳双键越多),熔、沸点越低,如:
(C17H35COO)3C3H5>(C17H33COO)3C3H5
硬脂酸甘油酯 油酸甘油酯
②原子晶体:要比较共价键的强弱。一般来说,原子半径越小,键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.如熔点:金刚石(C—C)>金刚砂 (Si—C)>晶体硅(Si—Si)>锗(Ge—Ge)。
③离子晶体:要比较离子键的强弱。一般来说,阴、阳离子电荷数越多,离子半径越小,离子键越强,熔、沸点越高,如熔点:MgO>NaCl,KF>KCl>KBr> KI。离子晶体的晶格能越大,其熔、沸点越高。
④金属晶体:要比较金属键的强弱。金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子间的静电作用越强,金属键越强,熔、沸点越高,反之越低,如熔点:Na<Mg<Al。
(3)元素周期表中ⅦA族卤素的单质(分子晶体) 的熔、沸点随原子序数递增而升高;笫IA族碱金属元素的单质(金属晶体)的熔、沸点随原子序数的递增而降低。如熔、沸点:Li>Na>K>Rb>Cs。
注意:上述总结的是一般规律,不能绝对化。在具体比较晶体的熔、沸点高低时,应先弄清晶体的类型,然后根据不同类型晶体进行判断,但应注意具体问题具体分析。如MgO为离子晶体,[大]为离子半径小且离子电荷多,离子键较强,其熔点(2852℃)要高于部分原子晶体,如SiO2(1710℃)。
金属晶体:
通过金属离子与自由电子间的较强作用(金属键)形成的单质晶体,熔沸点(除Hg外)高,导热性、延展性良好,易导电,硬度一般较大。
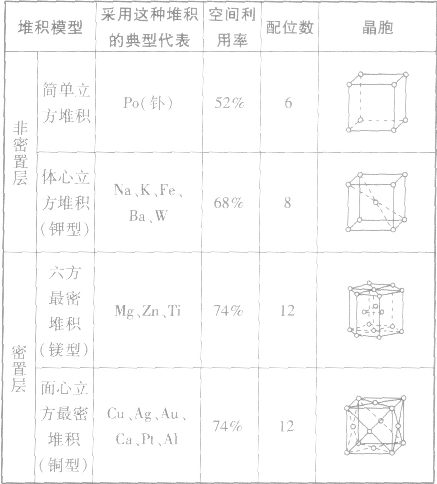
如:金属单质金属晶体原子堆积模型:
(1)简单立方堆积 (2)体心立方堆积 (3)六方最密堆积和面心立方最密堆积
晶体的基本类型与性质:
金属晶体的原子堆积模型: