本试题 “下图是一些重要工业生产的转化关系(反应条件略去)。请完成下列问题:(1)若D是单质,且与A属于同一主族,则:①反应的化学方程式是_________________________...” 主要考查您对单质硅
单质硫
氨气
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 单质硅
- 单质硫
- 氨气
硅:
①元素符号:Si
②原子结构示意图: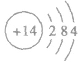
③电子式: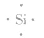
④周期表中位置:第三周期ⅣA族
⑤含量与存在:在地壳中的含量为26.3%,仅次于氧,在自然界中只以化合态存在
⑥同素异形体:晶体硅和无定形硅
硅的物理性质和化学性质:
(1)物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体,它的结构类似金刚石,具有较高的沸点和熔点,硬度也很大,它的导电性介于导体和绝缘体之间,是良好的半导体材料。 (2)化学性质:化学性质不活泼
①常温下,除与氟气、氢氟酸及强碱溶液反应外,与其他物质不反应 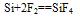
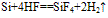 (雕刻玻璃)
(雕刻玻璃)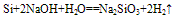
②在加热条件下,能与氧气、氯气等少数非金属单质化合
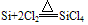
(4)制备:在电炉里用碳还原二氧化硅先制得粗硅: ,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为:
,将制得的粗硅,再与Cl2反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为: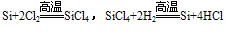 。
。
碳族元素中碳和硅的一些特殊规律:
1.金刚石和晶体硅都是原子晶体,但金刚石不导电,晶体硅能导电.且金刚石的熔点(大于3550℃)比硅的熔点(1410℃)高;石墨是过渡型晶体或混合型晶体,也能导电。
2.碳和硅都能跟O2反应生成氧化物,碳的两种氧化物CO和CO2在常温下是气体,而硅的氧化物SiO2 在常温下是固体。
3.碳跟碱溶液不反应,而硅跟碱溶液能反应。
Si+2NaOH+H2O==Na2SiO3+2H2↑
4.碳在高温时能跟水蒸气反应,而硅不能。
C+H2O(g) CO+H2
CO+H2
5.碳跟氢氟酸不反应,而硅能跟氢氟酸反应。
Si+4HF==SiF4↑+2H2↑
6.碳能被浓硫酸(或浓硝酸)氧化生成二氧化碳,但硅不能被浓硫酸(或浓硝酸)氧化。
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
C+4HNO3(浓) 4NO2↑+2H2O+CO2↑
4NO2↑+2H2O+CO2↑
7.碳和硅都具有还原性,且硅的还原性比碳强,但在高温时碳能把硅从SiO2中还原出来。
2C+SiO2 Si+2CO↑
Si+2CO↑
8.碳的氯化物都不能自燃,而SiH4能自燃。
SiH4+2O2==SiO2+2H2O
9.通常情况下,周态CO、CO2都是分子晶体,熔、沸点都很低;而SiO2是原子晶体,熔、沸点较高。
10.CO2溶于水且能跟水反应生成碳酸,SiO2却不能.
11.CO2跟氢氟酸不反应,而SiO2能跟氢氟酸反应.
SiO2+4HF==SiF4↑+2H2O
12.CO2跟碱溶液反嘘生成正盐或酸式盐,而SiO2 跟碱溶液反应只生成正盐。
CO2+2NaOH==Na2CO3+H2O
CO2+NaOH==NaHCO3
SiO2+2NaOH==Na2SiO3+H2O
13.在溶液中Na2SiO3可转变为Na2CO3,而在高温条件下Na2CO3又可转变为Na2SiO3。
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
硅及其化合物的几种反常现象:
1.Si的还原性大于C,但C却能在高温下还原出Si 可从平衡移动的角度理解,由于高温下生成了气态物质CO2它的放出降低了生成物的浓度,有利于应反正向进行,故可发生反应:SiO2+2C Si+2CO↑
Si+2CO↑
2.部分非金属单质能与碱溶液反应,但其中只有 Si与碱反应放出H2 常见的非金属单质与碱溶液的反应有:
Cl2+2NaOH==NaCl+NaClO+H2O①
3S+6NaOH 2Na2S+Na2SO3+3H2O②
2Na2S+Na2SO3+3H2O②
Si+2NaOH+H2O==Na2SiO3+2H2↑③
在反应①②中,Cl2、S既作氧化剂又作还原剂:在反应③中,Si为还原剂。
3.非金属单质一般不与弱氧化性酸反应,而硅不但能与氢氟酸反应,而且还会产生H2
4.硅酸不能由相应的酸酐与水反应制得制取硅酸的实际过程很复杂,条件不同可得到不同的产物,通常包括原硅酸(H2SiO4)及其脱水得到的一系列酸。原硅酸经两步脱水变为SiO2,SiO2是硅酸的酸酐,是一种不溶于水的同体,不能直接用它制备硅酸,用SiO2制取硅酸时,可先将SiO2溶于烧碱中,再向溶液中加入足量的盐酸或通入过量的CO2,析出的胶状物就是原硅酸,将原硅酸在空气中脱水即得硅酸,反应原理可理解为:
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+CO2+2H2O==Na2CO3+H4SiO4↓
H4SiO4==H2SiO3+H2O
5.非金属氧化物的熔沸点一般较低,但SiO2的熔沸点却很高非金属氧化物一般为分子晶体,但SiO2为原子晶体。分子晶体中分子以分子问作用力相结合,而分子间作用力很弱,破坏它使晶体变为液体或气体比较容易;而在SiO2晶体中每个硅原子与四个氧原子相结合,形成硅氧四面体,在每个硅氧四面体结构单元中Si—O 键的键能很高,同时硅氧四面体结构单元可通过共用顶角氧原子连成立体网状结构,所以要使它熔融,必须消耗更多的能量,因此SiO2的熔沸点很高。
6.SiO2是酸性氧化物却能跟HF作用
SiO2+4HF==SiF4↑+2H2O,此反应并不是因为HF的酸性,而是因为为常温下SiF4为气态物质,有利于反应正向进行,这是SiO2的突出特性,当然也是HF 的特性。
7.H2CO3的酸性强于H2SiO3。但却能发生如下反应:Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
强酸制备弱酸作为判断反应方向的依据,只适用于水溶液体系,而在非水溶液的条件下不一定适用,在高温下能发生反应:Na2CO3+SiO2 Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
Na2SiO3+ CO2↑的原因是H2SiO3难挥发,H2CO3易挥发,这符合高沸点物质制低沸点物质的反应规律,与此反应类似的还有:
2NaCl+H2SO4(浓) Na2SO4+2HCl↑
Na2SO4+2HCl↑
NaNO3+H2SO4(浓) NaHSO4+HNO3↑
NaHSO4+HNO3↑
上述两反应并不是由于H2SO4的强酸性,而是由于H2SO4为高沸点酸,HCl、HNO3为低沸点酸。
硅的用途:
高纯硅可作半导体材料,制造集成电路、晶体管、硅整流器等半导体器件,还可以制造太阳能电池。硅的合金用途也很广,如含硅4%的钢具有良好的导磁性,可用来制造变压器的铁芯;含硅15%左右的钢具有良好的耐酸性,可用来制造耐酸设备。
硫:
硫是一种非金属元素,化学符号是S,原子序数是16。单质硫是一种非常常见的无臭无味的非金属,纯的硫是黄色的晶体,又称作硫磺。
分子结构:硫元素有多种同素异形体 (由同一种元素形成的性质不同的单质)。若将硫的分子式设为 Sx,则x=1,2,3,4,5,6,7,8,9,10,12,18。Sx的分子结构可用如图表示。
硫的物理性质和化学性质:
(1)物理性质:硫为黄色晶体,俗称硫黄,质脆,易研成粉末。硫的密度比水大,不溶于水,微溶于酒精,易溶于CS。
(2)化学性质:硫位于第3周期ⅥA族,最外层有6个电子,在反应中易得到2个电子而呈-2价;硫的最高正价为+6价;单质硫的化合价为0,处于中间价态,故单质硫既有氧化性又有还原性,在反应中既可作氧化剂又可作还原剂。
如;
①弱氧化性
在加热的条件下,硫黄能被H:和绝大多数的金属单质还原。南于硫的氧化性比较弱,与变价金属反应时往往生成低价态的金属硫化物。例如: 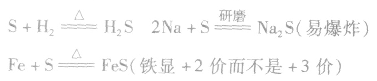

②弱还原性
在一定条件下,硫黄可被F2、O2、Cl2等非金属单质以及一些具有氧化性的化合物氧化,例如:

③硫黄在强碱溶液里加热可发生歧化反应。 (可用热碱液除去试管中残留的硫) 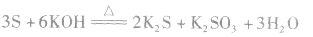
④特性:Hg、Ag在常温下不跟O2反应,但易跟S 反应。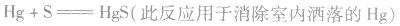
存在与用途:
存在:游离态的硫存在于火山喷口附近或地壳的岩层里,火山喷出物中含有大量含硫化合物,如H2S、 SO2、SO3等。化合态的硫主要以硫化物和硫酸盐的形式存在,如硫铁矿(FeS2)、石膏(CaSO4·2H2O)等。
用途:制H2SO4、黑火药、农药、医药和硫化橡胶。
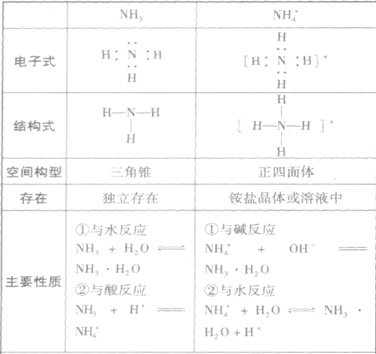
氨:
NH3的电子式为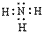 ,结构式为
,结构式为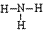 ,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为:
,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子。 分子结构为: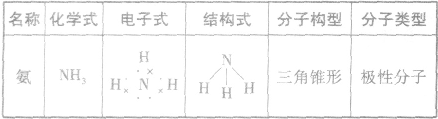
氨的物理性质和化学性质:
1.物理性质:
氨是无色、有刺激性气味的气体,比空气轻;氨易液化,在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热。液态氨气化时要吸收大量的热,使周围的温度急剧下降;氨气极易溶于水,在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);氨对人的眼、鼻、喉等粘膜有刺激作用,若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
2.化学性质:
(1)与水反应, ,氨的水溶液叫做氨水。在氨水中所含的微粒有:
,氨的水溶液叫做氨水。在氨水中所含的微粒有:
 氨水具有碱的通性,如能使无色酚酞溶液变红。
氨水具有碱的通性,如能使无色酚酞溶液变红。
(2)与酸反应生成铵盐反应实质为:
反应原理拓展NH3分子中N原子有一对孤电子,能够跟有空轨道的H+形成配位键: 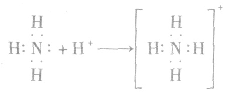
(3)具有还原性  (工业制HNO3的基础反应)
(工业制HNO3的基础反应) (Cl2过量)
(Cl2过量) (NH3过量,可用于检验Cl2瓶是否漏气)
(NH3过量,可用于检验Cl2瓶是否漏气)  (实验室制N2)
(实验室制N2)
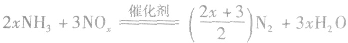 (治理氮氧化物污染)
(治理氮氧化物污染)
(4)与CO2反应制尿素 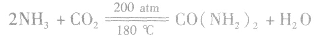
(5)配合反应
 的比较:
的比较:
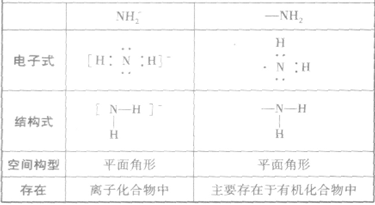
氨的结构与性质的关系总结:

氨的用途:
(1)氨是氮肥工业及制造硝酸、铵盐、纯碱等的重要原料。
(2)氨也是有机合成工业(如制尿素、合成纤维、染料等)上的常用原料。
(3)氨还可用作制冷剂。
对实验室制氨气常见问题的解释:
l.制取氨气时为什么用的铵盐一般是氯化铵而不是硝铵、硫铵或碳铵实验室制氨气用 固体混合反应,加热时反应速率显著增大。因为
固体混合反应,加热时反应速率显著增大。因为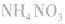 在加热时可能发生爆炸性的分解反应:
在加热时可能发生爆炸性的分解反应: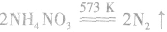
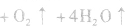 ,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成
,若用硝铵代替,在制氨气过程中可能会发生危险;因为碳铵受热极易分解出CO2:,使生成的NH3中混有较多CO2杂质,故不用碳铵;若用硫铵,由于反应时生成 ,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用
,易使反应混合物结块,产生的氨气不易逸出。故制NH3时选用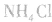 。
。
2.不用铵盐与强碱反应能否制取氨气能。
①加热浓度在20%以上的浓氨水,若浓度不够可加人适量固体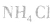 和生石灰(CaO)或烧碱:
和生石灰(CaO)或烧碱: 
②将浓氨水滴入盛有固体烧碱或生石灰(CaO)的烧瓶中,使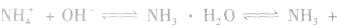
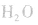 平衡右移,放出
平衡右移,放出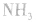 ,且NaOH、CaO溶于水均放热,可降低
,且NaOH、CaO溶于水均放热,可降低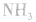 ,在水中的溶解度。
,在水中的溶解度。
③将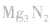 溶于水或使尿素在碱性条件下水解。
溶于水或使尿素在碱性条件下水解。 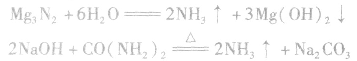
3.为什么制NH3用Ca(OH)2而不用NaOH ①固体NaOH易吸湿结块,不易与铵盐混合充分而反应;②在加热条件下,NaOH易腐蚀玻璃仪器。
4.制NH3的装置有哪些注意事项
①收集装置和发生装置的试管和导管必须是干燥的,因为氨气易溶于水;
②发生装置的试管口略向下倾斜,以免生成的水倒流使试管炸裂;
③导管应插入收集装置的底部,以排尽装置中的空气;
④收集NH3的试管口塞一团棉花,作用是防止NH3与空气形成对流,使收集的NH3较纯,还可防止NH3逸散到空气中。
5.用什么方法收集NH3只能用向下排空气法,因为NH3极易溶于水,密度又比空气小。
6.怎样收集干燥的NH3将NH3通过盛有碱石灰或固体NaOH的干燥管,但不能选用浓 、无水
、无水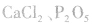 等作干燥剂,因为它们均能与NH3发生反应。
等作干燥剂,因为它们均能与NH3发生反应。
7.怎样检验NH3已充满试管把湿润的红色石蕊试纸放在试管口处,若试纸变蓝,则NH3已充满;把蘸有浓盐酸的玻璃棒接近试管口,若产生大量白烟,则NH3已充满。
与“下图是一些重要工业生产的转化关系(反应条件略去)。请完成...”考查相似的试题有:
- 光纤通信是一种现代化的通信手段,它可以提供大容量、高速度、高质量的通信服务。目前,我国正在大力建设高质量的宽带光纤通...
- 通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境...
- A、B、C、D、E、F、G各物质的相互转变关系如下图所示已知:A是地壳里含量居第二位的元素。E可用G与O2充分反应制得。(1)试推断...
- 在室温下,将PH=3的酸和PH=11的碱等体积混合,混合后溶液的PH小于7。则该酸和碱的组合可以是( )A.硝酸和氢氧化钠B.盐酸和...
- 铜与浓硫酸发生反应的化学方程式为:Cu+2 H2SO4(浓) △ CuSO4+ SO2↑ + 2 H2O,其中铜元素的化合价 (填“升高”或“降低”),被 ...
- 下列说法正确的是 ( )。A.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅B.金刚石是自然界中硬度最大的物质,...
- 请回答下列实验室中制取气体的有关问题。(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。装置B,C,D的作用分别是:B ...
- 在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据...
- 学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上.另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如右图...
- NH3是一种重要的化工原料,可以制备一系列物质见下图,下列说法正确的是[ ]A.NH4Cl和NaHCO3都是常用的化肥B.NH4Cl、HNO3和Na2...