本试题 “A、B两主族元素属于同一周期,它们的原子能以共价键结合成化学式为AB2型分子,A、B元素在周期表中的族序数可能为( )A.ⅠA、ⅤAB.ⅠA、ⅦAC.ⅣA、ⅥAD.ⅡA、ⅦA” 主要考查您对元素周期表
元素周期律
共价键
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 元素周期表
- 元素周期律
- 共价键
元素周期表编排原则:
(1)把电子层数相同的各种元素按原子序数递增的顺序从左至右排成横行。
(2)把最外层电子数相同的元素按电子层数递增的顺序由上到下排列成纵行。
注意:①元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
②历史上第一个元素周期表是1869年俄国化学家门捷列夫在前人探索的基础上排成的,他将元素按相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行。
元素周期表的结构:
(1)周期
①周期的含义在元素周期表中,把电子层数相同的元素,按原子序数递增的顺序从左到右排成横行,这样每个横行为一个周期。现在使用的元素周期表有7个横行,即7 个周期。
②周期的划分
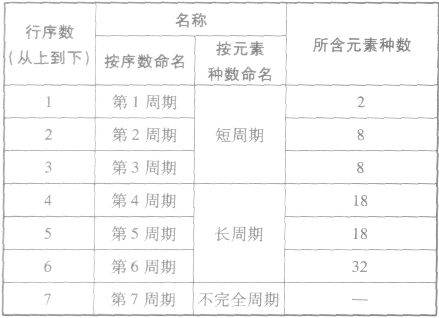
(2)族
①族的含义在周期表中,把不同横行(即周期)中最外层电子数相同的元素,按电子层数递增的顺序由上到下排成纵行,除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行为一族。现在使用的元素周期表有18 个纵行,它们被划分为16个族。
②族的划分
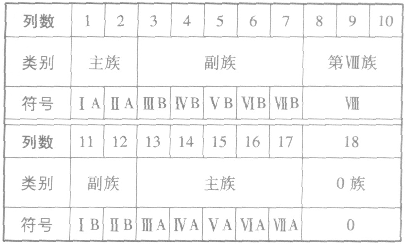
(3)元素周期表中主族元素金属性和非金属性的递变
定义:
元素的性质随原子序数的递增而呈现周期性变化的规律叫元素周期律。
实质:
元素性质随原子序数递增呈现周期性变化是元素原子的核外电子排布周期性变化的必然结果。
元素周期表中主族元素性质递变规律:

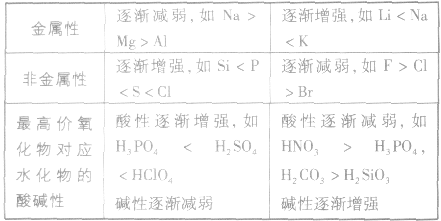
金属性强弱的判断依据:
1.单质跟水或酸反应置换出氢的难易程度(或反应的剧烈程度):反应越容易,说明其金属性越强。
2.最高价氧化物对应水化物的碱性强弱:碱性越强,说明其金属性越强,反之则越弱。
3.金属间的置换反应:依据氧化还原反应的规律,金属甲能从金属乙的盐溶液里置换出乙,说明甲的金属性比乙强。
4.金属活动性顺序按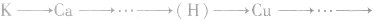 Au顺序,金属性逐渐减弱。
Au顺序,金属性逐渐减弱。
5.元素周期表中,同周期元素从左至右金属性逐渐减弱;同主族元素从上至下金属性逐渐增强。
6.原电池中的正负极:一般情况下,活泼金属作负极。
7.金属阳离子氧化性的强弱:阳离子的氧化性越强.对应金属的金属性就越弱。
非金属性强弱的判断依据:
1.同周期元素,从左到右,随核电荷数的增加,非金属性增强;同主族元素,从上到下,随着陔电荷数的增加,非金属性减弱。
2.最高价氧化物对应水化物的酸性强弱:酸性越强,其元素的非金属性也越强,反之则越弱。
3.气态氢化物的稳定性:稳定性越强,非金属性越强。
4.单质跟氢气化合的难易程度:越易与H2反应,说明其非金属性越强。
5.与盐溶液之间的置换反应:非金属元素甲的单质能从非金属乙的盐溶液中置换出乙,说明甲的非金属性比乙强。如 ,说明溴的非金属性比碘强。
,说明溴的非金属性比碘强。
6.相互化合后的价态:如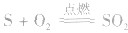 ,说明O 的非金属性强于S。
,说明O 的非金属性强于S。
7.其他:如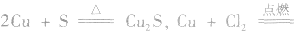 CuCl2,所以C1的非金属性强于S。
CuCl2,所以C1的非金属性强于S。
微粒半径大小的比较方法:
1.同周期元素的微粒
同周期元素的原子或最高价阳离子半径随核电荷数增大而减小(稀有气体元素除外),如半径:Na>Mg >Al,Na+>Mg2+‘>Al3+。
2.同主族元素的微粒
同主族元素的原子或离子半径随核电荷数增大而增大,如半径: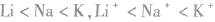
3.电子层结构相同的微粒电子层结构相同(核外电子排布相同)的微粒半径随核电荷数的增加而减小,如半径: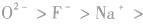
 (上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
(上一周期元素形成的阴离子与下一周期元素形成的最高价阳离子有此规律)。
4.同种元素形成的微粒同种元素原子形成的微粒半径大小为:阳离子< 中性原子<阴离子;价态越高的微粒半径越小,如半径: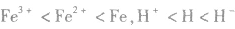 。
。
5.核外电子数和核电荷数都不同的微粒可通过一种参照物进行比较,如比较 的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子
的半径大小,可找出与A13+电子数相同,与S同主族的氧元素的阴离子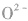 进行比较,半径:
进行比较,半径: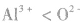 ,且
,且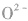
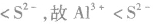
元素周期表中的几项重要规律相等规律:
| 规律 | 内容 |
| 相等规律 | ①周期数:电子层数 ②主族元素原子的最外层电子数=价电子数=主族序数=最高正化合价(F、 0除外) ③最低负价绝对值=8一主族序数(限 ⅣA族~ⅦA族非金属元素) |
| “位、构、性”规律 | |
| 递变规律 | 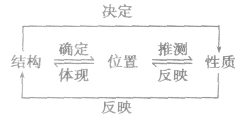 |
| 同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强同主族从上到下,元素的金属性逐渐增强,非金属性逐渐减弱 | |
| 奇偶规律 | 在同一主族内,族序数和原子序数、核内质子数、核电荷数、核外电子数、最外层电子数(价电子数)、离子的电荷数、元素的主要正负化合价数等,若一个是偶数,其他的都是偶数,若一个是奇数,其他的都是奇数 |
| 相同电子层结构的规律 | 稀有气体元素的原子与同周期非金属元素的阴离子以及下一周期主族金属元素的阳离子具有相同的电子层结构 |
| 序差规律 | ①同主族相邻元素的原子序数之差与主族序数有关。IA~ⅡA族元素相差原子序数较小的元素所在周期包含的元素种数。ⅢA族~O族元素相差原子序数较大的元素所在周期包含的元素种数。如Na和K的原子序数相差8 (第三周期含8种元素),Cl和Br的原子序数相差18(第四周期含18种元素) ②同周期主族元素(长周期)的原子序数差:两元素分布在过渡元素同侧时,原子序数差=族序数差;两元素分布在过渡元素两侧时,第四或第五周期元素原子序数差=族序数差+10(如第四周期的Ca和Ca相差11),第六、七周期元素原子序数差=族序数差+24(如ⅡA 族的Ba和ⅢA族的Tl相差25) |
| 对角线相似规律 | 周期表中位于对角线位置的元素性质相似,尤以“和Mg、Be和Al最为典型 |
共价键:
1.本质原子之间形成共用电子对(或电子云重叠),使得电子出现在核间的概率增大。
2.特征
具有方向性与饱和性。
(1)共价键的饱和性一个原子中的一个未成对电子与另一个原子中的一个未成对电子配对成键后,一般来说就不能再与其他原子的未成对电子配对成键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。
例如,氯原子中只有一个未成对电子,所以两个氯原子之间可以形成一个共价键,结合成氯分子,表示为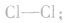 氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为
氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为 一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为
一个氮原子也可与_二个氢原子以三个共价键结合成氨分子,表示为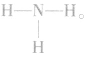
(2)共价键的方向性
共价键将尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。除s轨道是球形对称外,其他原子轨道都具有一定的空间分布。在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键就越牢固。
例如,硫原子的价电子排布是 有两个未成对电子,如果它们分布在互相垂直的
有两个未成对电子,如果它们分布在互相垂直的 轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的
轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢原子的1s轨道上的电子能与硫原子的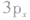 轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的
轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的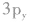 轨道上的电子配对成键。
轨道上的电子配对成键。
说明:
①共价键的饱和性决定着各种原子形成分子时相互结合的数量关系。如一个氢分子只能由两个氢原子构成,一个水分子只能由两个氢原子和一个氧原子构成。
②共价键的方向性决定着分子的空间构型。
3.分类
(1)按成键原子是否相同或共用电子对是否偏移分 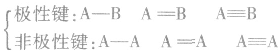
(2)按成键方式分

(3)按共用电子对数分
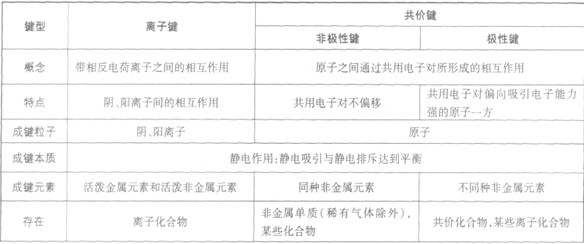
离子键和共价键:

与“A、B两主族元素属于同一周期,它们的原子能以共价键结合成化...”考查相似的试题有:
- (8分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电...
- 关于SO2分子与CO2分子说法正确的是A.均为非极性分子B.中心原子都采取sp杂化轨道C.S原子和C原子上都没有孤对电子D.SO2为V...
- 某些建筑材料含有放射性元素氡(),会对人体产生一定危害。该原子中中子数和质子数之差是( )A.136B.50C.86D.222
- (2013梅州质检,22)某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表—种元素,其中O点代...
- 下列对元素周期律和元素周期表的认识正确的是( )A.元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化B.核外...
- 张清莲是我国著名的化学家。1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值。这是原子量表中的...
- 短周期元素X,Y,Z、W在周期表中的位置如右图所示,则下列说法中错误的是A.X,Y,Z中X的单质最稳定B.W的最高价氧化物对应的...
- 2011年3月12日,日本福岛第一核电站由于地震原因而发生爆炸,造成放射性物质泄漏,核电站周围检测到铯137和碘131超标。核电站...
- (1)在元素周期表上述四个区域中,单质均能导电的是 。(a)A (b)B (c)C (d)D(2)最外电子层只有圆球形电子云的主族...
- 下列性质的递变规律不正确的是A.NaOH、KOH、CsOH碱性依次增强B.HCl、H2S、PH3稳定性依次减弱C.Al、Mg、Na的原子半径依次减...