本试题 “以下是小梦做过的小实验,我认为不能成功的是( )A.用蜡烛制取少量的炭黑B.用碎鸡蛋壳和食醋制取少量CO2C.用肥皂水区别硬水和软水D.用点燃的方法除去CO2...” 主要考查您对二氧化碳的制取和收集
蜡烛燃烧
硬水和软水
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 二氧化碳的制取和收集
- 蜡烛燃烧
- 硬水和软水
二氧化碳的制取和收集:
1.原理和药品:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.装置:固液混合不加热
(1)发生装置
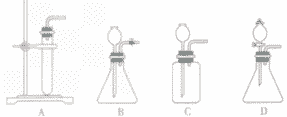
A装置为简易装置,不便于加液体;
B,C使用了长颈漏斗,便于添加液体,使用B、C装置时应注意,长颈漏斗下端管日应伸入液面以下,防止产生的气体从长颈漏斗逸出;
D装置使用了分液漏斗,便于加酸,还可以利用活塞控制反应。
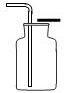
(2)收集装置:二氧化碳溶于水,所以不能用排水法收集;其密度比空气大,所以可采用向上排空气法收集。
如图:
3.现象:块状固体不断溶解,产生大量气泡。
4.检验:把产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明是二氧化碳。
5.验满:将燃着的木条放在集气瓶口,如果木条的火焰熄灭,证明已集满。
6.实验步骤
a.检查装置的气密性;
b.装入石灰石(或大理石);
c. 塞紧双孔塞;
d.从长颈漏斗中加入稀盐酸;
e.收集气体;
f.验满。
7.注意事项:反应物不能用浓盐酸、硫酸、因为浓盐酸易挥发,会挥发出氯化氢气体,使制得的二氧化碳不纯;硫酸不会挥发,但会生成硫酸钙沉淀,沉淀的硫酸根附着在碳酸钙(或石灰石)表面,使碳酸钙(或石灰石)与酸的接触面积变小,最后反应停止!
实验室制取二氧化碳的选择:
实验室用大理石或石灰石(主要成分是碳酸钙)和稀盐酸制取二氧化碳。
注意:
(1)不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会橙盖在碳酸钙的表面,阻止反应继续进行。
(2)不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
(3)不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。反应速率的快慢与反应物的质量分数和接触面积有关。反应物的接触面积越大,反应物的质量分数越大,反应速率就越快,反之,则越慢。
各组物质反应情况如下表所示:
| 药品 | 反应速率 |
| 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| 石灰石粉末和稀盐酸 | 产生气泡速率很快 |
| 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
对蜡烛及其燃烧的探究的:对蜡烛在点燃前、点燃时和熄灭后的三个阶段进行细致的观察,学会完整地观察物质的变化过程及其现象。
蜡烛燃烧实验探究:
1. 实验活动:
| 实验探究步骤 | 观察物质的性质、变化及现象 | 结论解释及文字表达式 | |
| 观察蜡烛的制作材料 | 烛心棉线,外部石蜡 | 石蜡制成 | |
| 点燃前 | 观察蜡烛的颜色、状态、形状 | 乳白色,固态,圆柱状 | 乳白色,固态 |
| 用小刀切下一块石蜡,投入水中 | 很容易切开,浮在水面上,难溶于水 | 密度比水小,较软,难溶于水 | |
| 点燃蜡烛 | 用火柴点燃蜡烛,观察蜡烛火焰 | 火焰分为三层,外层最明亮,内层最暗 | 火焰分为三层,外层最明亮,内层最暗 |
| 将一根火柴迅速平放在火焰中,1s后取出 | 外层最先炭化,内层最后炭化(甚至不炭化) | 外层温度最高 内层温度最低 | |
| 用一干而冷的烧杯罩在火焰上,片刻取下烧杯,迅速向烧杯内倒入少量澄清石灰水,振荡 | 烧杯内壁有水雾,澄清石灰水变浑浊 | 蜡烛燃烧生成了水和二氧化碳:蜡烛+氧气 水+二氧化碳 水+二氧化碳 | |
| 熄灭蜡烛 | 将蜡烛熄灭,观察 | 有白烟 | 蜡烛燃烧时先由固态转变为液态,再汽化,而后燃烧 |
| 用火柴迅速点燃刚熄灭时的白烟 | 白眼燃烧 | 白烟是石蜡的固体小颗粒 | |
2.结论:
综上所述,蜡烛能在空气中燃烧,发出黄白色火焰,放出热量,生成水并产生能使澄清石灰水变浑浊的气体——二氧化碳。
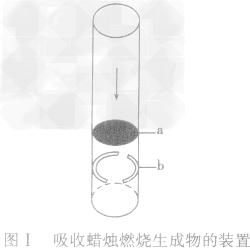
用来吸收蜡烛燃烧生成物的装置:
用燃烧蜡烛的方法验证质量守恒定律,为了保证正确的现象和结论,应如何设计实验装置?
蜡烛燃烧生成物为二氧化碳和水(气)。碱石灰能有效地吸收这两种物质。这种吸收装置的制作方法如下:
(1)截取一段长度为10cm,直径约为25mm的玻璃管(可用破了底的大试管截取)。
(2)装入金属网栅。从破旧石棉网上剪一块直径略大于玻璃管内径的圆网,从玻璃管的一端轻轻推入,使圆网撑住在离管口约2cm处作为放置碱石灰的网栅 (如网栅容易滑下,可以用回形针改制成一个带有弹性的圆环,弹紧在玻璃管的内壁作为挡圈,使网栅不致滑下).装置如图I所示。
(3)加入碱石灰,制成吸收器。碱石灰要选较大的颗粒,使间隙较大,保证气体流通。碱石灰层厚约4— 5cm。
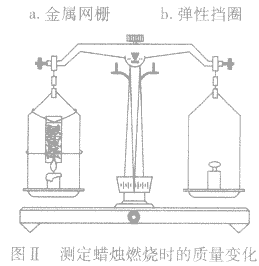
(4)将吸收器固定在天平左盘蜡烛的正上方(如图 Ⅱ),即可进行实验。
(5)这一实验成败关键在于蜡烛是否正常燃烧,生成的气体是否顺利通过吸收器。所以,蜡烛火焰的大小、吸收器离火焰的距离都要事先试验好。如果实验正常,3min后即有明显现象。天平最好选用感量为 0.02g的物理天平。
定义:
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
硬水是含有较多可溶性钙、镁化合物的水。
软水是不含或含较少可溶性钙、镁化合物的水。
水的硬度:
水的硬度常用一种规定的标准来衡量,这个标准是:把1L水里含10mgCaO(或相当于10mgCaO)称为1度。
硬水和软水的检验:
(1)用肥皂水来检验硬水和软水,把肥皂水滴在水里搅拌,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水
(2)用加热煮沸的方法检验硬水和软水。水加热煮沸时,有较多沉淀的是硬水,不产生沉淀或者产生沉淀较少的是软水。
硬水的软化:
就是设法除去硬水中的钙、镁化合物。
硬水软化的方法:生活中常用煮沸法,工业上常用离子交换法和药剂软化法,实验室常用蒸馏法,蒸馏法是净化程度较高的水,蒸馏时应注意以下几点:
①蒸馏瓶中的液体不能超过其容积的2/3.
②加热时,应在烧瓶中放几粒沸石(或碎瓷片)。
③装置气密性良好
④水银温度计的水银球应放在蒸馏烧瓶的支管口附近。
使用硬水造成的危害:
饮用水中含有微量的钙、镁成分,对人体健康是有益的。但是,水中含太多的钙、镁成分,对生活和生产都有危害。
①用硬水洗涤,不仅浪费肥皂,而且会在织物上积有肥皂跟钙、镁反应后生成的沉淀,不容易洗干净,还会使纤维变脆、易断。
②硬水有苦涩味,长期饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
③锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。另外,当水垢爆裂脱落时,会造成炉壁局部受热不均,易引起锅炉爆炸。
离子交换法:
离子交换法是工业生产软化水的重要方法之一。离子交换法的原理:离子交换树脂是一种聚合物,带有相应的功能基团(一般情况下,常规的钠离子交换树脂带有大量的钠离子),当含钙、镁离子较高的硬水经过离子交换树脂时,离子交换树脂即可以释放出钠离子,其功能基团与钙、镁离子结合。这样水中的钙、镁离子含量下降,水的硬度降低,硬水即可被软化为软水。离子交换法的流程为:工作(即交换)、反洗、再生、清洗四个过程。
发现相似题
与“以下是小梦做过的小实验,我认为不能成功的是( )A.用蜡烛...”考查相似的试题有:
- (7分) 根据下列实验装置图,回答问题:A B C(1)装置中标“a”的仪器名称是 。(2)实验室制取二氧化碳常用的药品是 ,应选...
- 下列有关氧气的制取、收集、验满、性质的实验中错误的是( ) . A.制取B.收集C.验满D.性质
- 下面①~⑥是实验室的部分仪器图,A~E是制取气体的几个装置图,按要求回答下列问题:(1)图中③仪器的名称为 。(2)量取5mL液...
- 某化学兴趣小组利用下图装置探究制取气体的原理、方法及性质。请结合下图,回答有关问题。 (1)写出图中标号仪器的名称:a ,b...
- 小明对蜡烛的燃烧进行了探究:(1)他观察蜡烛燃烧的火焰从内向外依次是______、和______、______.为了证明外焰的温度最高,...
- 学好化学能使我们更好地认识各种现象,更合理地解决实际问题,更轻松地应对生活中可能出现的突发事件。(1)常用洗洁精洗涤油...
- 今年甘肃南部舟曲县突发特大山洪泥石流,为防止疾病传染,需对河水处理后方可饮用,常用的措施有: ①加热煮沸 ②消毒杀菌(用漂白...
- 常用的净化水的方法有______、______、______、______等,实验室里常用______方法使硬水软化,在操作过程中常在水中加入几粒...
- 自来水是含有较多的钙镁物质的硬水,家里要把自来水转化为软水的方法是______;工业上要获得纯净水的方法是______.
- 下列说法正确的是[ ]A.无色、无臭、清澈透明的水一定是纯净物B.活性炭可以吸附掉一些溶解的杂质,除去臭味C.青少年长期饮...