本试题 “请在“二氧化硫、甲烷、熟石灰”中选择合适的物质填空:(填化学式)(1)能形成酸雨的空气污染物是______;(2)常用来改良酸性土壤的碱是______.(3)能产生...” 主要考查您对酸雨
空气的污染和防治
乙醇
有机化合物和无机化合物
中和反应及在实际中的应用
酸的用途
碱的用途
盐的用途
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸雨
- 空气的污染和防治
- 乙醇
- 有机化合物和无机化合物
- 中和反应及在实际中的应用
- 酸的用途
- 碱的用途
- 盐的用途
概念:
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2 SO2
SO2
二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2 2NO
2NO
一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2
 SO2
SO2 二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2
 2NO
2NO 一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
知识拓展:
1. 酸雨区
某地收集到酸雨样品,还不能算是酸雨区,因为一年可有数十场雨,某场雨可能是酸雨,某场雨可能不是酸雨,所以要看年均值。目前我国定义酸雨区的科学标准尚在讨论之中,但一般认为:年均降水pH高于5.65,酸雨率是0-20%,为非酸雨区;pH在5.30--5.60之间,酸雨率是10--40%,为轻酸雨区;pH在5.00--5.30之间,酸雨率是30-60%,为中度酸雨区;pH在4.70--5.00之间,酸雨率是50-80%,为较重酸雨区;pH小于4.70,酸雨率是70-100%,为重酸雨区。这就是所谓的五级标准。其实,北京、拉萨、西宁、兰州和乌鲁木齐等市也收集到几场酸雨,但年均pH和酸雨率都在非酸雨区标准内,故为非酸雨区。
2. 我国三大酸雨区
我国酸雨主要是硫酸型
我国三大酸雨区分别为:
(1)西南酸雨区:是仅次于华中酸雨区的降水污染严重区域。
(2)华中酸雨区:目前它已成为全国酸雨污染范围最大,中心强度最高的酸雨污染区。
(3)华东沿海酸雨区:它的污染强度低于华中、西南酸雨区。
空气污染:
即空气中含有一种或多种污染物,其存在的量、性质及时间会伤害到人类、植物及动物的生命,损害财物、或干扰舒适的生活环境,如臭味的存在。换言之,只要是某一种物质其存在的量,性质及时间足够对人类或其他生物、财物产生影响者,我们就可以称其为空气污染物;而其存在造成之现象,就是空气污染。换言之,某些物质在空气中不正常的增量就产生空气污染的情形。
空气污染治理:
1. 空气污染及来源
导致空气质量下降的污染物很多。目前量多且危害严重的空气污染物主要有二氧化硫(SO2)、氮氧化物 (NO2)、一氧化碳(CO)和可吸入颗粒物等。如下表所示:
2. 空气污染的危害
①酸雨:SO2、NOx等气体形成酸雨。
②臭氧层破坏:氟利昂的释放,加速臭氧分解。
③其他危害:空气污染严重危害了人体健康,影响了农作物生长,破坏了生态平衡。
3. 空气污染的防治
①改善燃料结构,尽量充分燃烧液体燃料和气体燃料。
②对化石燃料进行脱硫、脱氮处理,工厂的废气要经过处理再排放。
③开发新能源,如太阳能、风能、水能、地热能等。
④大力开展植树造林活动,提高环境的自我净化能力。
空气质量日报:
空气质量日报的主要内容:空气污染指数,首要污染物,空气质量级别,空气质量状况。
计入空气污染指数的项目:二氧化硫,一氧化碳,二氧化氮,可吸入颗粒物,臭氧等。
空气质量级别:
PM2.5
(1)什么是PM2.5:PM2.5是指大气中小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。它的直径还不到人的头发丝粗细的1/20。虽然PM2.5只是地球大气成分中含量很少的组分,但对空气质量和能见度等有重要影响。
(2)PM2.5的性状:与较粗的大气颗粒物相比,PM2.5粒径小,富含大量的有毒,有害物质且能在大气中停留时间长,输送距离远,因而对人体健康和大气环境质量的影响更大。
(3)PM2.5的来源:主要来源是日常发电,工业生产,汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属的等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自道路扬尘等,2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(机动车尾气,燃烧)、挥发性有机物等。
(4)2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标。
室内空气污染:
指由于各种原因导致的室内空气中有害物质超标.进而影响人体健康的室内环境污染。有害物质包括甲醛、苯、氨、放射性物质等。
即空气中含有一种或多种污染物,其存在的量、性质及时间会伤害到人类、植物及动物的生命,损害财物、或干扰舒适的生活环境,如臭味的存在。换言之,只要是某一种物质其存在的量,性质及时间足够对人类或其他生物、财物产生影响者,我们就可以称其为空气污染物;而其存在造成之现象,就是空气污染。换言之,某些物质在空气中不正常的增量就产生空气污染的情形。
空气污染治理:
1. 空气污染及来源
导致空气质量下降的污染物很多。目前量多且危害严重的空气污染物主要有二氧化硫(SO2)、氮氧化物 (NO2)、一氧化碳(CO)和可吸入颗粒物等。如下表所示:
| 空气污染物 | 主要来源 |
| 二氧化硫 | 煤、石油等燃料的燃烧,生产硫酸等工厂排放的尾气 |
| 一氧化碳 | 化石燃料等不完全燃烧 |
| 氮氧化物 | 机动车辆等排放的废气 |
| 可吸入颗粒物 | 地面扬尘、燃煤排放的粉尘等 |
2. 空气污染的危害
①酸雨:SO2、NOx等气体形成酸雨。
②臭氧层破坏:氟利昂的释放,加速臭氧分解。
③其他危害:空气污染严重危害了人体健康,影响了农作物生长,破坏了生态平衡。
3. 空气污染的防治
①改善燃料结构,尽量充分燃烧液体燃料和气体燃料。
②对化石燃料进行脱硫、脱氮处理,工厂的废气要经过处理再排放。
③开发新能源,如太阳能、风能、水能、地热能等。
④大力开展植树造林活动,提高环境的自我净化能力。
空气质量日报:
空气质量日报的主要内容:空气污染指数,首要污染物,空气质量级别,空气质量状况。
计入空气污染指数的项目:二氧化硫,一氧化碳,二氧化氮,可吸入颗粒物,臭氧等。
空气质量级别:
| 污染指数 | 50以下 | 51-100 | 101-150 | 151-200 | 201-250 | 251-300 | 300以上 |
| 质量级别 | Ⅰ | Ⅱ | Ⅲ⑴ | Ⅲ⑵ | Ⅳ⑴ | Ⅳ⑵ | Ⅴ |
| 质量状况 | 优 | 良 | 轻微污染 | 轻度污染 | 中度污染 | 中度重污染 | 重度污染 |
PM2.5
(1)什么是PM2.5:PM2.5是指大气中小于或等于2.5微米的颗粒物,也称为可入肺颗粒物。它的直径还不到人的头发丝粗细的1/20。虽然PM2.5只是地球大气成分中含量很少的组分,但对空气质量和能见度等有重要影响。
(2)PM2.5的性状:与较粗的大气颗粒物相比,PM2.5粒径小,富含大量的有毒,有害物质且能在大气中停留时间长,输送距离远,因而对人体健康和大气环境质量的影响更大。
(3)PM2.5的来源:主要来源是日常发电,工业生产,汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属的等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自道路扬尘等,2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(机动车尾气,燃烧)、挥发性有机物等。
(4)2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标。
室内空气污染:
指由于各种原因导致的室内空气中有害物质超标.进而影响人体健康的室内环境污染。有害物质包括甲醛、苯、氨、放射性物质等。
定义:
乙醇的结构简式为C2H5OH,俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。乙醇的用途很广,可用乙醇来制造醋酸、饮料、香精、染料、燃料等。医疗上也常用体积分数为70%——75%的乙醇作消毒剂等。
性状:无色透明液体(纯酒精),有特殊香味的气味,易挥发。能与水、氯仿、乙醚、甲醇、丙酮和其他多数有机溶剂混溶,相对密度(d15.56)0.816,易燃,蒸气能与空气形成爆炸性混合物。
危险特征:本品易燃,其蒸气与空气可形成爆炸性混合物。遇明火、高热能引起燃烧爆炸。与氧化剂接触发生化学反应或引起燃烧。在火场中,受热的容器有爆炸的危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
乙醇的性质:
1. 物理性质:性状无色透明、易燃易挥发液体。有酒的气味和刺激性辛辣味。
熔点-117.3℃
沸点78.32℃
相对密度0.7893
闪点14℃
溶解性溶于水、甲醇、乙醚和氯仿。能溶解许多有机化合物和若干无机化合物。
2. 化学性质:
氧化反应
(1)燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
不完全燃烧:2C2H5OH+5O2 2CO2+2CO+6H2O
2CO2+2CO+6H2O
安全措施:
泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄露:用砂土或其它不燃材料吸附或吸收。也可用大量水冲洗,洗水稀释后放入废水系统。
大量泄露:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
灭火方法:
燃烧性:极易燃
灭火剂:抗溶性泡沫、干粉、二氧化碳、砂土。
灭火注意事项:尽可能将容器从火场移至空旷处。喷水保持容器冷却,直至灭火结束。
紧急处理:
吸入:迅速脱离现场至新鲜空气,若现象严重要尽快就医。
误食:饮足量温水,催吐。若现象严重要尽快就医。
皮肤接触:脱去被污染衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。若现象严重要尽快就医。
实验室使用及灭火
(1)应使用火柴点燃,否则容易使酒精灯内的酒精燃烧。
(2)使用完毕后,应用灯帽将火盖灭。
(3)如不慎将酒精洒出并引燃,则应用湿抹布将其盖灭。
乙醇的用途:
溶剂;有机合成;各种化合物的结晶;洗涤剂;萃取剂;食用酒精可以勾兑白酒;用作粘合剂;硝基喷漆;清漆、化妆品、油墨、脱漆剂等的溶剂以及农药、医药、橡胶、塑料、人造纤维、洗涤剂等的制造原料、还可以做防冻剂、燃料、消毒剂等。 75%(体积分数)的乙醇溶液常用于医疗消毒。
乙醇和甲醇的区别:
①甲醇是甲烷的一个氢原子被羟基(一个氢和一个氧组成的原子团,不是氢氧根)替换后的产物。
乙醇是乙烷一个氢原子被羟基替换后的产物,俗称酒精。
②分子式不一样。
甲醇:CH3OH
乙醇:CH3CH2OH
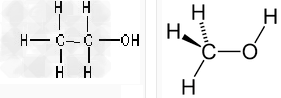
乙醇结构 甲醇结构
他们的分子式不一样,化学性质和物理性质也有区别。
③工业酒精里常含有甲醇,甲醇有毒,不能用工业酒精配制酒
乙醇汽油:
乙醇汽油也被称为(E型汽油),我国使用乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成。它可以改善油品的性能和质量,降低一氧化碳、碳氢化合物等主要污染物排放。
乙醇的结构简式为C2H5OH,俗称酒精,它在常温、常压下是一种易燃、易挥发的无色透明液体,它的水溶液具有特殊的、令人愉快的香味,并略带刺激性。乙醇的用途很广,可用乙醇来制造醋酸、饮料、香精、染料、燃料等。医疗上也常用体积分数为70%——75%的乙醇作消毒剂等。
性状:无色透明液体(纯酒精),有特殊香味的气味,易挥发。能与水、氯仿、乙醚、甲醇、丙酮和其他多数有机溶剂混溶,相对密度(d15.56)0.816,易燃,蒸气能与空气形成爆炸性混合物。
危险特征:本品易燃,其蒸气与空气可形成爆炸性混合物。遇明火、高热能引起燃烧爆炸。与氧化剂接触发生化学反应或引起燃烧。在火场中,受热的容器有爆炸的危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。
乙醇的性质:
1. 物理性质:性状无色透明、易燃易挥发液体。有酒的气味和刺激性辛辣味。
熔点-117.3℃
沸点78.32℃
相对密度0.7893
闪点14℃
溶解性溶于水、甲醇、乙醚和氯仿。能溶解许多有机化合物和若干无机化合物。
2. 化学性质:
氧化反应
(1)燃烧:发出淡蓝色火焰,生成二氧化碳和水(蒸气),并放出大量的热,不完全燃烧时还生成一氧化碳,有黄色火焰,放出热量
完全燃烧:C2H5OH+3O2
 2CO2+3H2O
2CO2+3H2O 不完全燃烧:2C2H5OH+5O2
 2CO2+2CO+6H2O
2CO2+2CO+6H2O安全措施:
泄漏:迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,防止进入下水道、排洪沟等限制性空间。
小量泄露:用砂土或其它不燃材料吸附或吸收。也可用大量水冲洗,洗水稀释后放入废水系统。
大量泄露:构筑围堤或挖坑收容;用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
灭火方法:
燃烧性:极易燃
灭火剂:抗溶性泡沫、干粉、二氧化碳、砂土。
灭火注意事项:尽可能将容器从火场移至空旷处。喷水保持容器冷却,直至灭火结束。
紧急处理:
吸入:迅速脱离现场至新鲜空气,若现象严重要尽快就医。
误食:饮足量温水,催吐。若现象严重要尽快就医。
皮肤接触:脱去被污染衣着,用流动清水冲洗。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。若现象严重要尽快就医。
实验室使用及灭火
(1)应使用火柴点燃,否则容易使酒精灯内的酒精燃烧。
(2)使用完毕后,应用灯帽将火盖灭。
(3)如不慎将酒精洒出并引燃,则应用湿抹布将其盖灭。
乙醇的用途:
溶剂;有机合成;各种化合物的结晶;洗涤剂;萃取剂;食用酒精可以勾兑白酒;用作粘合剂;硝基喷漆;清漆、化妆品、油墨、脱漆剂等的溶剂以及农药、医药、橡胶、塑料、人造纤维、洗涤剂等的制造原料、还可以做防冻剂、燃料、消毒剂等。 75%(体积分数)的乙醇溶液常用于医疗消毒。
乙醇和甲醇的区别:
①甲醇是甲烷的一个氢原子被羟基(一个氢和一个氧组成的原子团,不是氢氧根)替换后的产物。
乙醇是乙烷一个氢原子被羟基替换后的产物,俗称酒精。
②分子式不一样。
甲醇:CH3OH
乙醇:CH3CH2OH

乙醇结构 甲醇结构
他们的分子式不一样,化学性质和物理性质也有区别。
③工业酒精里常含有甲醇,甲醇有毒,不能用工业酒精配制酒
乙醇汽油:
乙醇汽油也被称为(E型汽油),我国使用乙醇汽油是用90%的普通汽油与10%的燃料乙醇调和而成。它可以改善油品的性能和质量,降低一氧化碳、碳氢化合物等主要污染物排放。
有机化合物:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
有机化合物与无机化合物的主要区别:
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
中和反应:
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
(1)定义:酸跟碱作用生成盐和水的反应,叫做中和反应。
(2)实质:酸中的氢离子与碱中的氢氧根离子作用生成水的过程。
概念理解:
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。如Fe2O3+6HCl==2FeCl3+3H2O不是中和反应
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。二者的关系是复分解反应包含了中和反应。
探究中和反应是否发生的方法:
酸与碱作用生成盐和水的反应叫中和反应,中和反应一般情况下没有明显的外观现象【H2SO4+ Ba(OH)2==BaSO4↓+2H2O除外】。
探究酸碱发生中和反应的方法有以下几种(以HCl和NaOH反应为例):
1. 指示剂法。先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
2. pH试纸法。先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时多次测定混合溶液的pH。如果测得pH逐渐变小且小于7,则证明 NaOH溶液与稀盐酸发生了化学反应。
3. 热量变化法。化学反应通常伴随着能量的变化.所以可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
中和反应的应用:
①改变土壤的酸碱性根据土壤情况,可以利用中和反应,在土壤中加人适量酸性或碱性物质,调节土壤的酸碱性,以利于植物生长。如:近年来由于空气污染造成的酸雨,导致一些地方的土壤显酸性,不利于农作物生长,人们通常向土壤中撒适量熟石灰中和其酸性。
②处理工厂的废水工厂里排出的废水有一些显酸性或碱性,直接排放会对水体和环境造成污染。通常在排出的废水中加入适量的碱性或酸性物质中和。如:废水中含有硫酸可向其中加人适从熟石灰,反应的化学方程式为:H2SO4+Ca(OH)2==CaSO4+2H2O。
③用于医药人体胃酸(主要成分是盐酸)过多,会造成消化不良,甚至会产生胃病,通常服用呈碱性的物质来消除症状,如氢氧化铝,反应的化学方程式为:3HCl+Al(OH)3== AlCl3+3H2O。被蚊虫叮咬(蚊虫能分泌出蚁酸)后,可在患处涂上显碱胜的物质,如:NH3·H2O。
酸的用途很广泛:
1. 盐酸:用于金属表面除锈,制造药物等,人体胃液中含有盐酸帮助消化。
2. 硫酸:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等;实验室常用作干燥剂。
3. 硝酸:主要应用于制造化肥,以及硝酸盐工业。
4. 醋酸:生活中既可作食品调味,也可用于清洗热水瓶内水垢。
1. 盐酸:用于金属表面除锈,制造药物等,人体胃液中含有盐酸帮助消化。
2. 硫酸:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油等;实验室常用作干燥剂。
3. 硝酸:主要应用于制造化肥,以及硝酸盐工业。
4. 醋酸:生活中既可作食品调味,也可用于清洗热水瓶内水垢。
常见的碱的用途:
1. 氢氧化钠:是重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业。实验室中可作干燥剂。
2. 氢氧化钙:用于建筑业,制漂白粉,改良土壤。常用于实验室二氧化碳的检验。
1. 氢氧化钠:是重要的化工原料,广泛用于肥皂、石油、造纸、纺织和印染等工业。实验室中可作干燥剂。
2. 氢氧化钙:用于建筑业,制漂白粉,改良土壤。常用于实验室二氧化碳的检验。
常见盐的用途:
1. 氯化钠(NaCl):作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料碳酸钠(Na2CO3):制烧碱,广泛用于玻璃、纺织、造纸等
2. 碳酸氧钠(NaHCO3):工业焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多
3. 碳酸钙(CaCO3):实验室制取CO2,重要的建筑材料,制补钙剂
4. 硫酸铜(CuSO4): 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜
5. 高锰酸钾(KMnO4):常作消毒剂
1. 氯化钠(NaCl):作调味品和防腐剂,医疗上配置生理盐水。重要的化工原料碳酸钠(Na2CO3):制烧碱,广泛用于玻璃、纺织、造纸等
2. 碳酸氧钠(NaHCO3):工业焙制糕点的发酵粉的主要成分,医疗上治疗胃酸过多
3. 碳酸钙(CaCO3):实验室制取CO2,重要的建筑材料,制补钙剂
4. 硫酸铜(CuSO4): 农业上配制波尔多液,实验室中用作水的检验试剂,精炼铜
5. 高锰酸钾(KMnO4):常作消毒剂
发现相似题
与“请在“二氧化硫、甲烷、熟石灰”中选择合适的物质填空:(填化...”考查相似的试题有:
- 维持人体生命活动所需的热量,主要由哪种能量直接转化而来A.太阳能B.化学能C.动能D.电能
- 下列产品的开发利用与环境保护无关的是( )A.加碘食盐B.无磷洗衣粉C.乙醇汽油D.脱硫煤
- 利用能源、节约能源是我们大家共同关注的社会问题。(1)最清洁的燃料是 (2)海底埋藏着大量的可燃冰,可成为未来的新能源,...
- 根据下列实验现象可以判断某溶液一定呈碱性的是( )A.常温下,测得溶液的pH<7B.溶液中滴入酚酞显红色C.溶液中滴入石蕊显红...
- 某黑色固体A进行如下反应: 请推断下列物质:① A是 (1),Z是 (2)。② X是 (3)。a.稀盐酸 b.稀硫酸 c.稀硝酸 d.稀硫酸或...
- 下列关于化肥、农药的说法中,正确的是A.尿素[CO(NH2)2]是一种常用的复合肥料B.为增强肥效,应将硫酸铵与熟石灰混合施用C....
- 盐酸、硫酸具有相似的化学性质,是因为它们 ( )A.都含有氢元素B.都含有氢分子C.都含有酸根D.溶液里的阳离子全部都是氢离子
- 下列生活中的常见物质能使无色酚酞试液变红的是A.食醋B.柠檬汁C.食盐水D.肥皂水
- 区分下列各组物质,所加试剂或操作方法都正确的是…………………………( )选项需要区分的物质方法一方法二A碳铵和硝铵闻气味加盐酸B硬...
- 下列物质中按酸、碱、盐顺序排列的是A.碳酸钠、硝酸、硫酸锌 B.硫酸亚铁、氢氧化钙、硫酸C.氯化钙、碳酸钙、氧化钙 D.盐...