本试题 “有关专家提出”以废治废”的治理污染新思路,并且起到了一定的成效.如冶炼钢铁时,为减少煤中硫燃烧生成的二氧化硫所造成的污染,一般是在煤燃烧时添加生石灰...” 主要考查您对酸雨
复分解反应
石灰石的利用
生石灰的性质和用途
碱的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 酸雨
- 复分解反应
- 石灰石的利用
- 生石灰的性质和用途
- 碱的性质
概念:
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2 SO2
SO2
二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2 2NO
2NO
一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
酸雨是指PH值小于5.6的雨雪或其他形式的降水。雨、雪等在形成和降落过程中,吸收并溶解了空气中的二氧化硫、氮氧化物等物质,形成了pH低于5.6的酸性降水。酸雨主要是人为的向大气中排放大量酸性物质造成的。我国的酸雨主要是因大量燃烧含硫量高的煤而形成的,多为硫酸雨,少为硝酸雨,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
酸雨形成的化学反应过程:
(1)酸雨多成于化石燃料的燃烧:
含有硫的煤燃烧生成二氧化硫 S+O2
 SO2
SO2 二氧化硫和水作用生成亚硫酸 SO2+H2O==H2SO3
亚硫酸在空气中可氧化成硫酸 2H2SO3+O2→2H2SO4
(2)氮氧化物溶于水形成酸:雷雨闪电时,大气中常有少量的二氧化氮产生。
闪电时氮气与氧气化合生成一氧化氮 N2+O2
 2NO
2NO 一氧化氮结构上不稳定,空气中氧化成二氧化氮 2NO+O2=2NO2
二氧化氮和水作用生成硝酸 3NO2+H2O=2HNO3+NO
(3)酸雨与大理石反应:
CaCO3+H2SO4==CaSO4+H2O+CO2↑ CaSO3+SO2+H2O==Ca(HSO3)2
(4)此外还有其他酸性气体溶于水导致酸雨,例如氟化氢,氟气,氯气,硫化氢等其他酸性气体。
酸雨防治:
(1)开发新能源,如氢能,太阳能,水能,潮汐能,地热能等。
(2)使用燃煤脱硫技术,减少二氧化硫排放。
(3)工业生产排放气体处理后再排放。
(4)少开车,多乘坐公共交通工具出行。
(5)使用天然气等较清洁能源,少用煤。
知识拓展:
1. 酸雨区
某地收集到酸雨样品,还不能算是酸雨区,因为一年可有数十场雨,某场雨可能是酸雨,某场雨可能不是酸雨,所以要看年均值。目前我国定义酸雨区的科学标准尚在讨论之中,但一般认为:年均降水pH高于5.65,酸雨率是0-20%,为非酸雨区;pH在5.30--5.60之间,酸雨率是10--40%,为轻酸雨区;pH在5.00--5.30之间,酸雨率是30-60%,为中度酸雨区;pH在4.70--5.00之间,酸雨率是50-80%,为较重酸雨区;pH小于4.70,酸雨率是70-100%,为重酸雨区。这就是所谓的五级标准。其实,北京、拉萨、西宁、兰州和乌鲁木齐等市也收集到几场酸雨,但年均pH和酸雨率都在非酸雨区标准内,故为非酸雨区。
2. 我国三大酸雨区
我国酸雨主要是硫酸型
我国三大酸雨区分别为:
(1)西南酸雨区:是仅次于华中酸雨区的降水污染严重区域。
(2)华中酸雨区:目前它已成为全国酸雨污染范围最大,中心强度最高的酸雨污染区。
(3)华东沿海酸雨区:它的污染强度低于华中、西南酸雨区。
复分解反应:
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
| 规律 | 发生的条件 |
| 金属氧化物+酸 | 生成物中有水,一般都能反应 |
| 酸+碱→盐+水 | 中和反应,有水生成,一般都能反应 |
| 酸+盐→新酸+新盐 | 生成物种有沉淀,气体或水 |
| 碱+盐→新碱+新盐 | 生成物种有沉淀,气体或水 |
| 盐1+盐2→新盐1+新盐2 | 生成物种有沉淀 |
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
定义:
碳酸钙(CaCO3)是一种难溶于水的白色固体。在自然界中,大理石、石灰石、方解石、白坐、蛋壳、珍珠等物质的主要成分均为碳酸钙;许多补钙药剂如钙片的主要成分也是碳酸钙。
碳酸钙的检验:
(1)碳酸钙的主要化学性质:CaCO3+2HCl==CaCl2+H2O+CO2↑(实验室制取CO2的原理) CaCO3 CaO+CO2↑(工业上制CO2)
CaO+CO2↑(工业上制CO2)
(2)碳酸钙的检验方法:
①方法:取少量碳酸钙放入试管中,加入稀盐酸,并将产生的无色气体通入澄清石灰水中。
②现象:产生大量气泡,澄清石灰水变浑浊。
③化学方程式:CaCO3+2HCl==CaCl2+H2O+CO2↑,CO2+Ca(OH)2==CaCO3↓+H2O
溶洞的形成:
溶洞都分布在石灰岩组成的山地中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会发生反应生成溶解度较大的碳酸氢钙:CaCO3+CO2+H2O==Ca(HCO3)2;
溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳:Ca(HCO3)2==CaCO3↓+CO2↑+H2O 洞顶的水在慢慢向下渗漏时,水中的碳酸氢钙发生上述反应,有的沉积在洞顶,有的沉积在洞底,日久天长洞顶处形成钟乳石,洞底处形成石笋,当钟乳石与石笋相连时就形成了石柱。
碳酸钙(CaCO3)是一种难溶于水的白色固体。在自然界中,大理石、石灰石、方解石、白坐、蛋壳、珍珠等物质的主要成分均为碳酸钙;许多补钙药剂如钙片的主要成分也是碳酸钙。
碳酸钙的检验:
(1)碳酸钙的主要化学性质:CaCO3+2HCl==CaCl2+H2O+CO2↑(实验室制取CO2的原理) CaCO3
 CaO+CO2↑(工业上制CO2)
CaO+CO2↑(工业上制CO2) (2)碳酸钙的检验方法:
①方法:取少量碳酸钙放入试管中,加入稀盐酸,并将产生的无色气体通入澄清石灰水中。
②现象:产生大量气泡,澄清石灰水变浑浊。
③化学方程式:CaCO3+2HCl==CaCl2+H2O+CO2↑,CO2+Ca(OH)2==CaCO3↓+H2O
溶洞的形成:
溶洞都分布在石灰岩组成的山地中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会发生反应生成溶解度较大的碳酸氢钙:CaCO3+CO2+H2O==Ca(HCO3)2;
溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳:Ca(HCO3)2==CaCO3↓+CO2↑+H2O 洞顶的水在慢慢向下渗漏时,水中的碳酸氢钙发生上述反应,有的沉积在洞顶,有的沉积在洞底,日久天长洞顶处形成钟乳石,洞底处形成石笋,当钟乳石与石笋相连时就形成了石柱。
生石灰:
凡是以碳酸钙为主要成分的天然岩石,如石灰岩、白垩、白云质石灰岩等,都可用来生产石灰。 主要成分:氧化钙(CaO)。
物理性质:
一般呈块状,纯的为白色,含有杂质时为淡灰色或淡黄色。
化学性质:
在空气中吸收水和二氧化碳。氧化钙与水作用生成氢氧化钙,并放出热量。化学反应方程式为:CaO+H2O==Ca(OH)2
产品用途
1.可作填充剂,例如:用作环氧胶黏剂的填充剂;
2.用作分析试剂,气体分析时用作二氧化碳吸收剂,光谱分析试剂,高纯试剂用于半导体生产中的外延、扩散工序,实验室氨气的干燥及醇类脱l水等;
3.用作原料,可制造电石、纯碱、漂白粉等,也用于制革、废水净化,氢氧化钙及各种钙化合物;
4.可用作建筑材料、冶金助熔剂,水泥速凝剂,荧光粉的助熔剂。
5.用作植物油脱色剂,药物载体,土壤改良剂和钙肥;
6.还可用于耐火材料、干燥剂;
7.可配制农机1、2号胶和水下环氧胶黏剂,还用作与2402树脂预反应的反应剂;
8.用于酸性废水处理及污泥调质;
9.还可用作锅炉停用保护剂,利用石灰的吸湿能力,使锅炉水汽系统的金属表面保持干燥,防止腐蚀,适用于低压、中压、小容量汽包锅炉的长期停用保护;
注意事项:
1、使用操作过程时间越短越好,放置在包装容器内的适当处,起到密封吸湿的作用。
2、存放在干燥库房中,防潮,避免与酸类物接触。
3、运输过程中避免受潮,小心轻放,以防止包装破损而影响产品质量。
4、禁止食用,万一入口,用水漱口立即求医。(切记不能饮水,生石灰是碱性氧化物遇水会腐蚀!)
与熟石灰,石灰乳的区别:
1. 与熟石灰
①石灰有生石灰和熟石灰之分。生石灰的主要成分是氧化钙(CaO),白色固体耐火难溶。将(CaO)含量高的石灰岩在通风的石灰窑中锻烧至900℃以上即得。是有吸水性,可用作干燥剂,我国民间常用以防止杂物回潮。与水反应(同时放出大量的热),或吸收潮湿空气中的水分,即成熟石灰[氢氧化钙Ca(OH)2,又称“消石灰”。熟石灰在一升水中溶解1.56克(20℃),它的饱和溶液称为“石灰水”,呈碱性,在空气中吸收二氧化碳而成碳酸钙沉淀。
②与熟石灰的转化与硬化
生石灰(CaO)与水反应生成氢氧化钙的过程,称为石灰的熟化或消化。反应生成的产物氢氧化钙称为熟石灰或消石灰。
石灰熟化时放出大量的热,体积增大1—2.0倍。煅烧良好、氧化钙含量高的石灰熟化较快,放热量和体积增大也较多。工地上熟化石灰常用两种方法:消石灰浆法和消石灰粉法。
生石灰熟化后形成的石灰浆中,石灰粒子形成氢氧化钙胶体结构,颗粒极细(粒径约为1μm),比表面积很大(达10~30m2/g),其表面吸附一层较厚的水膜,可吸附大量的水,因而有较强保持水分的能力,即保水性好。将它掺入水泥砂浆中,配成混合砂浆,可显著提高砂浆的和易性。
石灰依靠干燥结晶以及碳化作用而硬化,由于空气中的二氧化碳含量低,且碳化后形成的碳酸钙硬壳阻止二氧化碳向内部渗透,也妨碍水分向外蒸发,因而硬化缓慢,硬化后的强度也不高,1:3的石灰砂浆28d的抗压强度只有0.2~0.5MPa。在处于潮湿环境时,石灰中的水分不蒸发,二氧化碳也无法渗入,硬化将停止;加上氢氧化钙微溶于水,已硬化的石灰遇水还会溶解溃散。因此,石灰不宜在长期潮湿和受水浸泡的环境中使用。
石灰在硬化过程中,要蒸发掉大量的水分,引起体积显著收缩,易出现干缩裂缝。所以,石灰不宜单独使用,一般要掺人砂、纸筋、麻刀等材料,以减少收缩,增加抗拉强度,并能节约石灰。 石灰具有较强的碱性,在常温下,能与玻璃态的活性氧化硅或活性氧化铝反应,生成有水硬性的产物,产生胶结。因此,石灰还是建筑材料工业中重要的原材料。
2. 与石灰乳
石灰乳一般是在氧化钙中加水生成的,因为氢氧化钙溶解度不是很大,所以往往生成的是氢氧化钙的悬浊液(即水溶液中还存在着没有溶解的氢氧化钙),这就是石灰乳
石灰乳是石灰浆用水稀释后的混浊液。 指石灰加入过量的水(约为石灰质量的2.5-3倍)后得到的浆体。
凡是以碳酸钙为主要成分的天然岩石,如石灰岩、白垩、白云质石灰岩等,都可用来生产石灰。 主要成分:氧化钙(CaO)。
物理性质:
一般呈块状,纯的为白色,含有杂质时为淡灰色或淡黄色。
化学性质:
在空气中吸收水和二氧化碳。氧化钙与水作用生成氢氧化钙,并放出热量。化学反应方程式为:CaO+H2O==Ca(OH)2
产品用途
1.可作填充剂,例如:用作环氧胶黏剂的填充剂;
2.用作分析试剂,气体分析时用作二氧化碳吸收剂,光谱分析试剂,高纯试剂用于半导体生产中的外延、扩散工序,实验室氨气的干燥及醇类脱l水等;
3.用作原料,可制造电石、纯碱、漂白粉等,也用于制革、废水净化,氢氧化钙及各种钙化合物;
4.可用作建筑材料、冶金助熔剂,水泥速凝剂,荧光粉的助熔剂。
5.用作植物油脱色剂,药物载体,土壤改良剂和钙肥;
6.还可用于耐火材料、干燥剂;
7.可配制农机1、2号胶和水下环氧胶黏剂,还用作与2402树脂预反应的反应剂;
8.用于酸性废水处理及污泥调质;
9.还可用作锅炉停用保护剂,利用石灰的吸湿能力,使锅炉水汽系统的金属表面保持干燥,防止腐蚀,适用于低压、中压、小容量汽包锅炉的长期停用保护;
注意事项:
1、使用操作过程时间越短越好,放置在包装容器内的适当处,起到密封吸湿的作用。
2、存放在干燥库房中,防潮,避免与酸类物接触。
3、运输过程中避免受潮,小心轻放,以防止包装破损而影响产品质量。
4、禁止食用,万一入口,用水漱口立即求医。(切记不能饮水,生石灰是碱性氧化物遇水会腐蚀!)
与熟石灰,石灰乳的区别:
1. 与熟石灰
①石灰有生石灰和熟石灰之分。生石灰的主要成分是氧化钙(CaO),白色固体耐火难溶。将(CaO)含量高的石灰岩在通风的石灰窑中锻烧至900℃以上即得。是有吸水性,可用作干燥剂,我国民间常用以防止杂物回潮。与水反应(同时放出大量的热),或吸收潮湿空气中的水分,即成熟石灰[氢氧化钙Ca(OH)2,又称“消石灰”。熟石灰在一升水中溶解1.56克(20℃),它的饱和溶液称为“石灰水”,呈碱性,在空气中吸收二氧化碳而成碳酸钙沉淀。
②与熟石灰的转化与硬化
生石灰(CaO)与水反应生成氢氧化钙的过程,称为石灰的熟化或消化。反应生成的产物氢氧化钙称为熟石灰或消石灰。
石灰熟化时放出大量的热,体积增大1—2.0倍。煅烧良好、氧化钙含量高的石灰熟化较快,放热量和体积增大也较多。工地上熟化石灰常用两种方法:消石灰浆法和消石灰粉法。
生石灰熟化后形成的石灰浆中,石灰粒子形成氢氧化钙胶体结构,颗粒极细(粒径约为1μm),比表面积很大(达10~30m2/g),其表面吸附一层较厚的水膜,可吸附大量的水,因而有较强保持水分的能力,即保水性好。将它掺入水泥砂浆中,配成混合砂浆,可显著提高砂浆的和易性。
石灰依靠干燥结晶以及碳化作用而硬化,由于空气中的二氧化碳含量低,且碳化后形成的碳酸钙硬壳阻止二氧化碳向内部渗透,也妨碍水分向外蒸发,因而硬化缓慢,硬化后的强度也不高,1:3的石灰砂浆28d的抗压强度只有0.2~0.5MPa。在处于潮湿环境时,石灰中的水分不蒸发,二氧化碳也无法渗入,硬化将停止;加上氢氧化钙微溶于水,已硬化的石灰遇水还会溶解溃散。因此,石灰不宜在长期潮湿和受水浸泡的环境中使用。
石灰在硬化过程中,要蒸发掉大量的水分,引起体积显著收缩,易出现干缩裂缝。所以,石灰不宜单独使用,一般要掺人砂、纸筋、麻刀等材料,以减少收缩,增加抗拉强度,并能节约石灰。 石灰具有较强的碱性,在常温下,能与玻璃态的活性氧化硅或活性氧化铝反应,生成有水硬性的产物,产生胶结。因此,石灰还是建筑材料工业中重要的原材料。
2. 与石灰乳
石灰乳一般是在氧化钙中加水生成的,因为氢氧化钙溶解度不是很大,所以往往生成的是氢氧化钙的悬浊液(即水溶液中还存在着没有溶解的氢氧化钙),这就是石灰乳
石灰乳是石灰浆用水稀释后的混浊液。 指石灰加入过量的水(约为石灰质量的2.5-3倍)后得到的浆体。
碱的定义:
碱是指在溶液中电离成的阴离子全部是OH-的化合物。碱由金属离子(或铵根离子)和氢氧根离子构成,可用通式R(OH)n表示。从元素组成来看,碱一定含有氢元素和氧元素。
常见的碱:
(1)氢氧化钠、氢氧化钙都属于碱。除这两种碱外,常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)、治疗胃酸过多的药物中的氢氧化铝[Al(OH)3)。
(2)晶体(固体)吸收空气里的水分.表而潮湿而逐步溶解的现象叫做潮解。氢氧化钠、粗盐、氯化镁等物质都易潮解,应保存在密闭干燥的地方。同时称量 NaOH固体时要放在玻璃器皿中,不能放在纸上,防止 NaOH固体潮解后腐蚀天平的托盘。
(3)熟石灰可由生石灰(CaO)与水反应制得,反应的化学方程式为:CaO+H2O==Ca(OH)2,反应时放出大量的热。
碱的通性
常见的碱有NaOH、KOH、Ca(OH)2、氨水的特性:
①氢氧化钠(NaOH)俗名苛性钠、火碱、烧碱,这是因为它有强腐蚀性。NaOH是一种可溶性强碱。白色固体,极易溶于水,暴露在空气中易潮解,可用作碱性气体(如NH3)或中性气体(如H2、O2、CO等)的干燥剂。NaOH易与空气中的CO2反应生成Na2CO3固体。NaOH溶液可以腐蚀玻璃,盛NaOH溶液的试剂瓶不能用磨口的玻璃塞,只能用橡胶塞。
②氢氧化钙[Ca(OH)2]是白色粉末,微溶于水,俗称熟石灰或消石灰,其水溶液称为石灰水。Ca(OH)2也有腐蚀作用。Ca(OH)2与CO2反应生成白色沉淀CaCO3,常用于检验CO2。 Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2能跟Na2CO3反应生成NaOH,用于制取NaOH。反应方程式为: Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③氨水(NH3·H2O)是一种可溶性弱碱,NH3溶于水可得氨水。有刺激性气味,有挥发性。将氨气通过盛放氧化铜的玻璃管,生成氮气、水和铜,其反应方程式为: 2NH3+3CuO=(加热)=3Cu+N2↑+3H2O,说明氨气具有还原性。
此外,KOH、Ba(OH)2也是常见的可溶性强碱。不溶的碱大多是弱碱,如:Fe(OH)3、Cu(OH)2等。他们的共同性质是热稳定性差,受热易分解生成对应的金属氧化物和水。
氢氧化钠、氢氧化钙的物理性质和用途比较
氢氧化钠、氢氧化钙化学性质的比较
几种碱的颜色和溶解度
概念性质的理解
①氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沽到皮肤.上或洒在衣服上。如果不慎将碱液沽到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
②浓硫酸、氢氧化钠固体溶于水放热,属于物理变化;而氧化钙溶于水放热是氧化钙与水反应放出大量的热,属于化学变化;生石灰具有强烈的吸水性,可以作某些气体的干燥剂。
③由于NaOH易潮解,同时吸收空气中的CO2发生变质,所以NaOH必须密封保存。
④保存碱溶液的试剂瓶应用橡胶塞、不能用玻璃塞,以防止长期不用碱溶液,碱溶液腐蚀玻璃造成打不开的情况。
⑤只有可溶性碱溶液才能使指示剂变色,如NaOH溶液能使无色酚酞变红;但不溶性碱不能使指示剂变色,如Mg(OH)2中滴加无色酚酞,酚酞不变色。
⑥盐和碱的反应,反应物中的盐和碱必须溶于水,生成物中至少有一种难溶物、气体或H2O。铵盐与碱反应生成的碱不稳定,分解为NH3和H2O。
⑦碱与酸的反应中碱可以是不溶性碱,如 Cu(OH)2+H2SO4==CuSO4+2H2O。
氢氧化钠和氢氧化钙的鉴别:
NaOH与Ca(OH)2的水溶液都能使酚酞变红,故鉴别NaOH和Ca(OH)2不能用指示剂,通常情况下,可采用以下两种方法来鉴别NaOH和Ca(OH)2
方法一:通入CO2气体,NaOH溶液与CO2气体反应后无明显现象,但Ca(OH)2溶液即澄清石灰水与 CO2反应生成白色沉淀。
方法二:滴加Na2CO3溶液或K2CO3溶液,NaOH溶液与K2CO3,Na2CO3溶液不反应,但Ca(OH)2溶液与 Na2CO3、K2CO3溶液反应均生成白色沉淀。Ca(OH)2+ Na2CO3==CaCO3↓+2NaOH,Ca(OH)2+K2CO3 ==Na2CO3+2KOH。
检验二氧化碳气体是否与氢氧化钠溶液反应的方法
通常情况下,将二氧化碳气体直接通人装有氢氧化钠溶液的试管中,很难直接判断二氧化碳气体是否与氢氧化钠溶液反应。因此,要判断二氧化碳气体确实能与氢氧化钠反应,可以采取如下两种方法:
(1)检验产物的方法:验证通入二氧化碳气体后的溶液中是否含有碳酸钠,检验碳酸根离子是否存在。通常检验碳酸根离子的方法是:
方法1:取样,加入稀盐酸,并将产生的气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明溶液中存在碳酸根离子。
方法2:取样,加入氢氧化钙溶液,若产生白色沉淀,则证明溶液中存在碳酸根离子。上述两种方法其实也可以检验氢氧化钠溶液是否变质.而且方法I还可以用于除去变质后的氢氧化钠溶液中的碳酸钠。
(2)改进实验装置,通过一些明显的实验现象间接证明二氧化碳气体能与氢氧化钠反应。如:
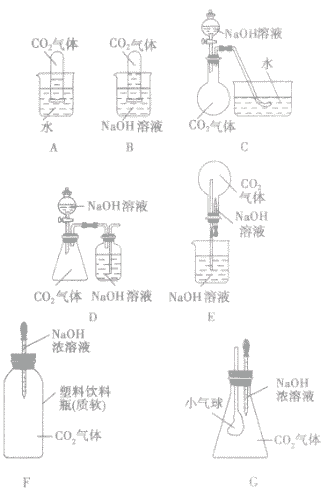
碱的命名:
一般读作氢氧化某,如:NaOH读作氢氧化钠。变价金属元素形成的碱,高价金属碱读作氢氧化某,如Fe(OH)3读作氢氧化铁,低价金属碱读作氢氧化亚某,如Fe(OH)2读作氢氧化亚铁。
氨水:
氨气的水溶液俗称氨水,主要成分是NH3·H2O,通常状况下是无色液体,具有挥发性。浓氨水能挥发出具有刺激性气味的氨气NH3。
氨水显碱性,能使指示剂变色。
氨水的组成中含有N元素,因此可通过与酸反应生成铵盐来制氮肥,其本身也是一种氮肥。在化学实验中一般可用浓氨水做分子运动的探究实验。
碱是指在溶液中电离成的阴离子全部是OH-的化合物。碱由金属离子(或铵根离子)和氢氧根离子构成,可用通式R(OH)n表示。从元素组成来看,碱一定含有氢元素和氧元素。
常见的碱:
(1)氢氧化钠、氢氧化钙都属于碱。除这两种碱外,常见的碱还有氢氧化钾(KOH)、氨水(NH3·H2O)、治疗胃酸过多的药物中的氢氧化铝[Al(OH)3)。
(2)晶体(固体)吸收空气里的水分.表而潮湿而逐步溶解的现象叫做潮解。氢氧化钠、粗盐、氯化镁等物质都易潮解,应保存在密闭干燥的地方。同时称量 NaOH固体时要放在玻璃器皿中,不能放在纸上,防止 NaOH固体潮解后腐蚀天平的托盘。
(3)熟石灰可由生石灰(CaO)与水反应制得,反应的化学方程式为:CaO+H2O==Ca(OH)2,反应时放出大量的热。
碱的通性
| 碱的通性 | 反应规律 | 化学方程式 | 反应类型 |
| 碱溶液与指示剂的反应 | 碱溶液能使紫色石蕊试液变蓝,无色酚酞试液变红 | —— | —— |
| 碱与非金属氧化物反应 | 碱+非金属氧化物→盐+水 | 2NaOH+CO2==Na2CO3+H2O Ca(OH)2+CO2==CaCO3↓+H2O |
—— |
| 碱与酸反应 | 碱+酸→盐+水 | NaOH+HCl==NaCl+H2O 2NaOH+H2SO4==Na2SO4+2H2O |
复分解反应 |
| 碱与某些盐反应 | 碱1+盐1→碱2+盐2 | 2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 Ca(OH)2+Na2CO3==CaCO3↓+2NaOH |
复分解反应 |
| 碱+铵盐→氨气+水+盐 | NH4Cl+NaOH NaCl+NH3↑+H2O NaCl+NH3↑+H2O |
复分解反应 |
常见的碱有NaOH、KOH、Ca(OH)2、氨水的特性:
①氢氧化钠(NaOH)俗名苛性钠、火碱、烧碱,这是因为它有强腐蚀性。NaOH是一种可溶性强碱。白色固体,极易溶于水,暴露在空气中易潮解,可用作碱性气体(如NH3)或中性气体(如H2、O2、CO等)的干燥剂。NaOH易与空气中的CO2反应生成Na2CO3固体。NaOH溶液可以腐蚀玻璃,盛NaOH溶液的试剂瓶不能用磨口的玻璃塞,只能用橡胶塞。
②氢氧化钙[Ca(OH)2]是白色粉末,微溶于水,俗称熟石灰或消石灰,其水溶液称为石灰水。Ca(OH)2也有腐蚀作用。Ca(OH)2与CO2反应生成白色沉淀CaCO3,常用于检验CO2。 Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2能跟Na2CO3反应生成NaOH,用于制取NaOH。反应方程式为: Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③氨水(NH3·H2O)是一种可溶性弱碱,NH3溶于水可得氨水。有刺激性气味,有挥发性。将氨气通过盛放氧化铜的玻璃管,生成氮气、水和铜,其反应方程式为: 2NH3+3CuO=(加热)=3Cu+N2↑+3H2O,说明氨气具有还原性。
此外,KOH、Ba(OH)2也是常见的可溶性强碱。不溶的碱大多是弱碱,如:Fe(OH)3、Cu(OH)2等。他们的共同性质是热稳定性差,受热易分解生成对应的金属氧化物和水。
氢氧化钠、氢氧化钙的物理性质和用途比较
| 俗名 | 苛性钠,火碱,烧碱 | 熟石灰,消石灰 |
| 颜色、状态 | 白色,片状固体 | 白色,粉末状固体 |
| 腐蚀性 | 强烈腐蚀性 | 较强腐蚀性 |
| 溶解性 | 易溶于水,易潮解,溶解时放热 | 微溶于水,其水溶液俗称石灰水 |
| 用途 | 化工原料,用于肥皂、石油、纺织、印染工业等;生活中用于除油污 | 用于建筑工业,制漂自粉,改良土壤,配制农药等 |
氢氧化钠、氢氧化钙化学性质的比较
| 氢氧化钠 | 氢氧化钙 |
| 跟指示剂作用.使紫色石蕊试液变成蓝色,使无色酚酞试液变成红色 | 跟指示剂作用,使紫色石蕊试液变成蓝色,使无色酚酞试液变成红色 |
| 跟某些非金属氧化物反应 2NaOH+CO2==Na2CO3+H2O 2NaOH+SO2==Na2SO3+H2O 2NaOH+SO3==Na2SO4+H2O |
跟某些非金属氧化物反应 Ca(OH)2+CO2==CaCO3↓+H2O Ca(OH)2+SO2==CaSO3↓+H2O Ca(OH)2+SO3==CaSO4+H2O |
| 跟酸发生中和反应 2NaOH+H2SO4==Na2SO4+2H2O |
跟酸发生中和反应 Ca(OH)2+H2SO4==CaSO4+2H2O |
| 跟某些盐反应 2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 |
跟某些盐反应 Ca(OH)2+Na2CO3==CaCO3↓+2NaOH |
几种碱的颜色和溶解度
| 碱 | 颜色 | 溶解性 |
| NaOH、KOH、Ba(OH)2 | 白色 | 易溶 |
| Ca(OH)2 | 白色 | 微溶 |
| Mg(OH)2、Al(OH )3、Fe(OH )2 | 白色 | 难溶 |
| Fe(OH )3 | 红褐色 | 难溶 |
| Cu(OH)2 | 蓝色 | 难溶 |
概念性质的理解
①氢氧化钠有强烈的腐蚀性,使用时必须十分小心,要防止沽到皮肤.上或洒在衣服上。如果不慎将碱液沽到皮肤上,应立即用较多的水冲洗,再涂上硼酸溶液。
②浓硫酸、氢氧化钠固体溶于水放热,属于物理变化;而氧化钙溶于水放热是氧化钙与水反应放出大量的热,属于化学变化;生石灰具有强烈的吸水性,可以作某些气体的干燥剂。
③由于NaOH易潮解,同时吸收空气中的CO2发生变质,所以NaOH必须密封保存。
④保存碱溶液的试剂瓶应用橡胶塞、不能用玻璃塞,以防止长期不用碱溶液,碱溶液腐蚀玻璃造成打不开的情况。
⑤只有可溶性碱溶液才能使指示剂变色,如NaOH溶液能使无色酚酞变红;但不溶性碱不能使指示剂变色,如Mg(OH)2中滴加无色酚酞,酚酞不变色。
⑥盐和碱的反应,反应物中的盐和碱必须溶于水,生成物中至少有一种难溶物、气体或H2O。铵盐与碱反应生成的碱不稳定,分解为NH3和H2O。
⑦碱与酸的反应中碱可以是不溶性碱,如 Cu(OH)2+H2SO4==CuSO4+2H2O。
氢氧化钠和氢氧化钙的鉴别:
NaOH与Ca(OH)2的水溶液都能使酚酞变红,故鉴别NaOH和Ca(OH)2不能用指示剂,通常情况下,可采用以下两种方法来鉴别NaOH和Ca(OH)2
方法一:通入CO2气体,NaOH溶液与CO2气体反应后无明显现象,但Ca(OH)2溶液即澄清石灰水与 CO2反应生成白色沉淀。
方法二:滴加Na2CO3溶液或K2CO3溶液,NaOH溶液与K2CO3,Na2CO3溶液不反应,但Ca(OH)2溶液与 Na2CO3、K2CO3溶液反应均生成白色沉淀。Ca(OH)2+ Na2CO3==CaCO3↓+2NaOH,Ca(OH)2+K2CO3 ==Na2CO3+2KOH。
检验二氧化碳气体是否与氢氧化钠溶液反应的方法
通常情况下,将二氧化碳气体直接通人装有氢氧化钠溶液的试管中,很难直接判断二氧化碳气体是否与氢氧化钠溶液反应。因此,要判断二氧化碳气体确实能与氢氧化钠反应,可以采取如下两种方法:
(1)检验产物的方法:验证通入二氧化碳气体后的溶液中是否含有碳酸钠,检验碳酸根离子是否存在。通常检验碳酸根离子的方法是:
方法1:取样,加入稀盐酸,并将产生的气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明溶液中存在碳酸根离子。
方法2:取样,加入氢氧化钙溶液,若产生白色沉淀,则证明溶液中存在碳酸根离子。上述两种方法其实也可以检验氢氧化钠溶液是否变质.而且方法I还可以用于除去变质后的氢氧化钠溶液中的碳酸钠。
(2)改进实验装置,通过一些明显的实验现象间接证明二氧化碳气体能与氢氧化钠反应。如:

| 所选装置 | 操作方法 | 实验现象 |
| A | 将充满二氧化碳的试管倒扣在水中 | 试管内的液面略有上升 |
| B | 将充满二氧化碳的试管倒扣在氢氧化钠溶液中 | 试管内的液面明显上升 |
| C | 将氢氧化钠溶液滴入烧瓶 | 水槽中的水倒吸入烧瓶内 |
| D | 将氢氧化钠溶液滴入锥形瓶 | 集气瓶中,NaOH溶液中的长导管下端产生气泡 |
| E | 将胶头滴管中氢氧化钠溶液挤入烧瓶 | 烧瓶内产生“喷泉” 现象 |
| F | 将胶头滴管中的氢氧化钠溶液挤入软塑料瓶 | 塑料瓶变瘪 |
| G | 将胶头滴管中的氢氧化钠溶液挤入锥形瓶中 | 小气球胀大 |
碱的命名:
一般读作氢氧化某,如:NaOH读作氢氧化钠。变价金属元素形成的碱,高价金属碱读作氢氧化某,如Fe(OH)3读作氢氧化铁,低价金属碱读作氢氧化亚某,如Fe(OH)2读作氢氧化亚铁。
氨水:
氨气的水溶液俗称氨水,主要成分是NH3·H2O,通常状况下是无色液体,具有挥发性。浓氨水能挥发出具有刺激性气味的氨气NH3。
氨水显碱性,能使指示剂变色。
氨水的组成中含有N元素,因此可通过与酸反应生成铵盐来制氮肥,其本身也是一种氮肥。在化学实验中一般可用浓氨水做分子运动的探究实验。
发现相似题
与“有关专家提出”以废治废”的治理污染新思路,并且起到了一定的...”考查相似的试题有:
- 随着经济的发展,能源和环境日益成为人们关注的焦点。(1)目前,人类以化石燃料为主要能源。常见的化石燃料包括煤、 和天然...
- 下列有关环境污保护的叙述中,错误的是( )。A.“温室气体”主要指CO2、CH4等能导致地球升温的气体B.“白色污染”主要指白色粉...
- 根据所学的知识,按要求填空(1)空气中最多的气体是______(2)海水中最多的元素是______(3)酥脆的饼干在空气中放置,逐渐...
- 下列叙述中,错误的是[ ]A.化学是一门以实验为基础的自然科学B.稀硫酸溶液能导电C.由两种物质反应生成另外两种物质的反应都叫...
- 同学们在复习完酸碱盐的相关性质后又开展复分解反应研究性学习,进一步从微观角度探究复分解反应的条件,设计了如下研究性学...
- 下列物质的转化能实现的是( )A.H2SO4HClB.CO Na2CO3C.Cu(OH)2NaOHD.NaNO3Ba(NO3)2
- 根据你的生活经验,下列说法或做法错误的是( )A.用活性炭可除去冰箱中的异味B.用醋酸不能除去热水瓶内的水垢C.硬水洗衣...
- 同学们在学习酸碱的化学性质时构建了如图知识网络,A、B、C、D是不同类别的无机化合物,“—”表示物质在一定条件下可以发生化学...
- 下列叙述不符合实验事实的是A.将二氧化碳气体通入CaCl2溶液,产生白色沉淀B.久置于空气中的熟石灰加入稀盐酸会有气体放出C...
- 2008年春节前夕,我省遭遇冰雪灾害.为了清除道路上的冰雪,有关部门投入了大量工业盐融雪剂用于除冰.同学们从资料中得知:①...