本试题 “下图是两组物质之间在一定的条件下相互转化的过程.下列关于相互转化的说法不正确的是( )A.X是O2B.该转化可以维持自然界中的二氧化碳和氧气的相对平衡C....” 主要考查您对自然界中的氧循环
质量守恒定律
化学反应中的能量变化
自然界中的碳循环
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 自然界中的氧循环
- 质量守恒定律
- 化学反应中的能量变化
- 自然界中的碳循环
氧循环:
动植物的呼吸作用及人类活动中的燃烧都需要消耗氧气,产生二氧化碳。但植物的光合作用却大量吸收二氧化碳,释放氧气,如此构成了生物圈的氧循环(氧循环和碳循环是相互联系的)。
氧气循环示意图:
工业燃烧、动植物的呼吸消耗空气中的氧气
通过植物的光合作用产生氧气

质量守恒定律的概念及对概念的理解:
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。
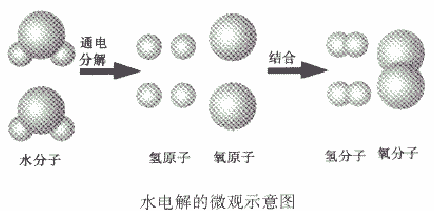
质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
(1)概念:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律就叫做质量守恒定律。
(2)对概念的理解:
①质量守恒定律只适用于化学反应,不能用于物理变化例如,将2g水加热变成2g水蒸气,这一变化前后质量虽然相等,但这是物理变化,不能说它遵守质量守恒定律。
②质量守恒定律指的是“质量守恒”,不包括其他方面的守恒,如对反应物和生成物均是气体的反应来说,反应前后的总质量守恒,但是其体积却不一定守恒。
③质量守恒定律中的第一个“质量”二字,是指“参加”化学反应的反应物的质量,不是所有反应物质量的任意简单相加。
例如,2g氢气与8g氧气在点燃的条件下,并非生成10g水,而是1g氢气与8g氧气参加反应,生成9g水
④很多化学反应中有气体或沉淀生成,因此“生成的各物质质量总和”包括了固态、液态和气态三种状态的物质,不能把生成的特别是逸散到空气中的气态物质计算在“总质量”之外而误认为化学反应不遵循质量守恒定律
质量守恒定律的微观实质:
(1)化学反应的实质在化学反应过程中,参加反应的各物质(反应物) 的原子,重新组合而生成其他物质(生成物)的过程。由分子构成的物质在化学反应中的变化过程可表示为:

(2)质量守恒的原因在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子本身的质量也没有改变,所以,反应前后的质量总和必然相等。例如,水通电分解生成氢气和氧气,从微观角度看:当水分子分解时,生成氢原子和氧原子,每两个氢原子结合成一个氢分子,每两个氧原子结合成一个氧分子。

质量守恒定律的延伸和拓展理解:
质量守恒定律要抓住“六个不变”,“两个一定变”“两个可能变”。
| 六个不变 | 宏观 | 反应前后的总质量不变 |
| 元素的种类不变 | ||
| 元素的质量不变 | ||
| 微观 | 原子的种类不变 | |
| 原子的数目不变 | ||
| 原子的质量不变 |
| 两个一定变 | 物质的种类一定变 |
| 构成物质的分子种类一定变 |
| 两个可能变 | 分子的总数可能变 |
| 元素的化合价可能变 |
如从水电解的微观示意图能得出的信息:
①在化学反应中,分子可以分成原子,原子又重新组合成新的分子;
②一个水分子是由两个氢原子和一个氧原子构成的,或一个氧分子由两个氧原子构成、一个氧分子由两个氢原子构成。或氢气、氧气是单质,水是化合物
③原子是化学变化中的最小粒子。
④水是由氢、氧两种元素组成的。
⑤在化学反应,氧元素的种类不变。
⑥在化学反应中,原子的种类、数目不变。
⑦参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律的发现:
1. 早在300多年前,化学家们就对化学反应进行定量研究。1673年,英国化学家波义耳(RobertBoyle, 1627-1691)在一个敞口的容器中加热金属,结果发现反应后容器中物质的质量增加了。
2. 1756年,俄国化学家罗蒙诺索夫把锡放在密闭的容器里锻烧,锡发生变化,生成白色的氧化锡,但容器和容器里物质的总质量,在锻烧前后并没有发生变化。经过反复实验,都得到同样的结果,于是他认为在化学变化中物质的质量是守恒的。
3. 1774年,法国化学家拉瓦锡用精确的定量实验法,在密封容器中研究氧化汞的分解与合成中各物质质量之间的关系,得到的结论是:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
4. 后来.人们用先进的测址仪器做了大量精度极高的实验,确认拉瓦易的结论是正确的。从此,质量守恒定律被人们所认识。
质量守恒定律的应用:
(1)解释问题
①解释化学反应的本质—生成新物质,不能产生新元素(揭示伪科学的谎言问题)。
②解释化学反应前后物质的质量变化及用质量差确定某反应物或生成物。
(2)确定反应物或生成物的质量
确定反应物或生成物的质量时首先要遵循参加反应的各种物质的质量总量等于生成的各种物质的质量总和;其次各种物质的质量比等于相对分子质量与化学计量数的乘积之比。
(3)确定物质的元素组成
理解在化学反应前后,元素的种类不发生改变。可通过计算确定具体的元素质量。
(4)确定反应物或生成物的化学式
比较反应前后各种原子个数的多少,找出原子个数的差异。但不能忘记化学式前的化学计量数。
(5)确定某物质的相对分子质量(或相对原子质量)
运用质量守恒定律确定某物质的相对分子质量 (或相对原子质量)时,首先寻找两种已知质量的物质,再根据化学方程式中各物质间的质量成正比即可计算得出。注意观察物质化学式前面的化学计量数。
(6)确定化学反应的类型
判定反应的类型,首先根据质量守恒定律判断反应物、生成物的种类和质量(从数值上看,反应物质量减少,生成物质最增加)。如果是微观示意图,要对比观察减少的粒子和增加的粒子的种类和数目再进行判断。
(7)判断化学方程式是否正确
根据质量守恒定律判断化学方程式的对与否关键是看等号两边的原子总数是否相等,同时注意化学式书写是否有误。
定义:
化学反应不仅有物质的变化,还伴随着能量的变化,通常表现为热量变化。有些化学反应会放出热量(称为放热反应),如燃烧、镁和盐酸反应等;也有些反应会吸收热量(称为吸热反应),如碳与二氧化碳反应(C+CO2 2CO)。
2CO)。
常见的吸热反应:
化学上把最终表现为吸收热量的反应叫吸热反应,初中化学所涉及的吸热反应主要有以下几种:
①C+CO2 2CO
2CO
C+2CuO 2Cu+CO2↑
2Cu+CO2↑
CaCO3 CaO+CO2↑
CaO+CO2↑
3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
可见,一般反应条件为高温的反应是吸热反应。
常见的放热反应:
化学上把最终表现为放出热量的反应叫放热反应,初中化学所涉及的放热反应主要有以下几种:
①燃烧:所有燃烧均会放热,如CH4+2O2 CO2+2H2O,H2+Cl2
CO2+2H2O,H2+Cl2 2HCl;
2HCl;
②酸碱中和:酸与碱反应生成盐和水,同时放出热量,如H2SO4+2NaOH==Na2SO4+2H2O
③活拨金属与酸发生置换反应生成H2,同时放出热量,如Mg+2HCl==MgCl2+H2↑,Zn+H2SO4== ZnSO4+H2↑。
④缓慢氧化也是放热反应,如铁生锈、食物腐烂过程中均放出热量。
⑤其他:如双氧水分解是放热反应
人类生活对能量的利用:
①生活燃料的利用:做饭、取暖等;
②利用燃料烧烧产生的能量:发电、制陶瓷、冶炼金属和发射火箭;
③利用爆炸产生的巨大能量:开山炸石、拆除违规建筑;
④食物在体内发生缓慢氧化放出热量,维持体温
化学反应不仅有物质的变化,还伴随着能量的变化,通常表现为热量变化。有些化学反应会放出热量(称为放热反应),如燃烧、镁和盐酸反应等;也有些反应会吸收热量(称为吸热反应),如碳与二氧化碳反应(C+CO2
 2CO)。
2CO)。 常见的吸热反应:
化学上把最终表现为吸收热量的反应叫吸热反应,初中化学所涉及的吸热反应主要有以下几种:
①C+CO2
 2CO
2CO C+2CuO
 2Cu+CO2↑
2Cu+CO2↑ CaCO3
 CaO+CO2↑
CaO+CO2↑ 3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2 可见,一般反应条件为高温的反应是吸热反应。
常见的放热反应:
化学上把最终表现为放出热量的反应叫放热反应,初中化学所涉及的放热反应主要有以下几种:
①燃烧:所有燃烧均会放热,如CH4+2O2
 CO2+2H2O,H2+Cl2
CO2+2H2O,H2+Cl2 2HCl;
2HCl;②酸碱中和:酸与碱反应生成盐和水,同时放出热量,如H2SO4+2NaOH==Na2SO4+2H2O
③活拨金属与酸发生置换反应生成H2,同时放出热量,如Mg+2HCl==MgCl2+H2↑,Zn+H2SO4== ZnSO4+H2↑。
④缓慢氧化也是放热反应,如铁生锈、食物腐烂过程中均放出热量。
⑤其他:如双氧水分解是放热反应
人类生活对能量的利用:
①生活燃料的利用:做饭、取暖等;
②利用燃料烧烧产生的能量:发电、制陶瓷、冶炼金属和发射火箭;
③利用爆炸产生的巨大能量:开山炸石、拆除违规建筑;
④食物在体内发生缓慢氧化放出热量,维持体温
碳循环:
生物圈中的碳循环主要表现在绿色植物从空气中吸收二氧化碳,经光合作用转化为葡萄糖,并放出氧气(O2)。
碳循环的描述:
碳循环是维持地球表层生命活动的主要物质循环。地球表层系统中的碳,绝大部分
以沉积物的形式储存在岩石圈中的储存库里。储存库中的碳,以碳水化合物的形式
存在于有机物质中(如岩石中的石油、天然气、煤),或以无机物的形式存在于矿
物碳酸盐中(如碳酸钙)。储存库里的碳,一般情况下是不参加碳循环的,除非岩
石被风化,化石燃料被利用,或火山活动将其以CO2和CO的形式带到大气中。大气
活性库中的碳,不到全部碳的2%。它主要是通过生物的呼吸作用来补充的,火山喷
发、人类燃烧化石燃料也是重要的来源。植物光合作用吸收大气中的CO2,生产有机
化合物,然后通过食物链传递。海洋中的浮游植物还可以直接生成碳酸盐骨骼。生物
死亡后,生物体沉降到海底形成沉积层。海洋浮游植物生成的有机质,同样也沉降到
海底,最终转变成石油和天然气。在适宜的地质条件下,陆地上的植物积累形成泥炭,
这种泥炭可以转变成煤、石油、天然气和煤被称为化石燃料,是碳的巨大储藏库。当
这些化石燃料被发掘、利用,燃烧生成的CO2和CO又会释放到大气中,参与碳循环。
碳的循环示意图:
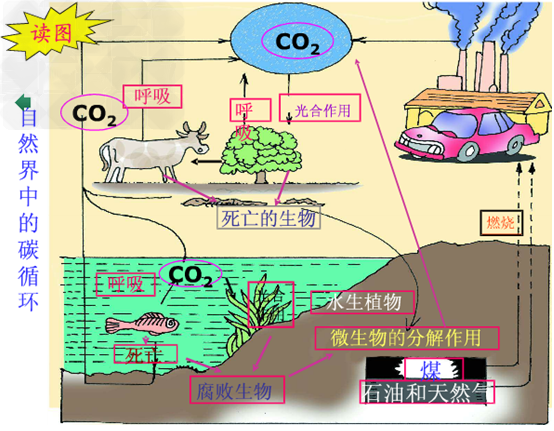
产生及消耗二氧化碳的途径:
(1)自然界消耗二氧化碳的途径:光合作用
(2)自然界产生二氧化碳的途径:
①主要途径:化石燃料的燃烧
②次要途径:呼吸作用,微生物的分解作用
生物圈中的碳循环主要表现在绿色植物从空气中吸收二氧化碳,经光合作用转化为葡萄糖,并放出氧气(O2)。
碳循环的描述:
碳循环是维持地球表层生命活动的主要物质循环。地球表层系统中的碳,绝大部分
以沉积物的形式储存在岩石圈中的储存库里。储存库中的碳,以碳水化合物的形式
存在于有机物质中(如岩石中的石油、天然气、煤),或以无机物的形式存在于矿
物碳酸盐中(如碳酸钙)。储存库里的碳,一般情况下是不参加碳循环的,除非岩
石被风化,化石燃料被利用,或火山活动将其以CO2和CO的形式带到大气中。大气
活性库中的碳,不到全部碳的2%。它主要是通过生物的呼吸作用来补充的,火山喷
发、人类燃烧化石燃料也是重要的来源。植物光合作用吸收大气中的CO2,生产有机
化合物,然后通过食物链传递。海洋中的浮游植物还可以直接生成碳酸盐骨骼。生物
死亡后,生物体沉降到海底形成沉积层。海洋浮游植物生成的有机质,同样也沉降到
海底,最终转变成石油和天然气。在适宜的地质条件下,陆地上的植物积累形成泥炭,
这种泥炭可以转变成煤、石油、天然气和煤被称为化石燃料,是碳的巨大储藏库。当
这些化石燃料被发掘、利用,燃烧生成的CO2和CO又会释放到大气中,参与碳循环。
碳的循环示意图:

产生及消耗二氧化碳的途径:
(1)自然界消耗二氧化碳的途径:光合作用
(2)自然界产生二氧化碳的途径:
①主要途径:化石燃料的燃烧
②次要途径:呼吸作用,微生物的分解作用
发现相似题
与“下图是两组物质之间在一定的条件下相互转化的过程.下列关于...”考查相似的试题有:
- 文字表达式书写(每个2分)铁在氧气中燃烧: 红磷在空气中燃烧: 硫粉在空气中燃烧: 加热氯酸钾制氧气:
- 下列实验现象描述正确的是A.红磷在氧气中燃烧发出耀眼的白光,并产生大量的白雾B.细铁丝在氧气中燃烧火星四射,生成四氧化...
- 2007年4月14日4时11分,我国在西昌卫星发射中心用“长征三号甲”运载火箭,成功将一颗北斗导航卫星送入太空.某种运载火箭所使...
- 在一个密闭容器中加入四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:物质甲乙丙丁 反应前质量/g35207 反...
- 葡萄糖与氧气作用是动植物呼吸的主要反应:C6H12Ox+6O2═6CO2+6H2O,请判断C6H12Ox中,x的值是( )A.12B.9C.6D.3
- 在化学反应前后,肯定不会变化的是:①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥物质的体积 ⑦物质的...
- 在2H2+O2 点燃 . 2H2O反应前后,①物质的质量总和②物质种类③元素种类④原子总数⑤分子总数⑥元素化合价中没有发生改变的是( )A...
- 关于一氧化碳燃烧(2CO+O2 点燃 . 2CO2)说法正确的是( )A.反应过程中吸收大量的热B.反应前后分子个数不变C.参加反应的...
- 实验探究.如右图,小试管中装有混有硝酸钾固体的硝酸钾的饱和溶液,烧杯中装有一定的水,先向烧杯中加入适量生石灰,试管中...
- 在学习过程中,小雨同学提出一个问题:“碳燃烧时可能生成CO2,也可能生成C0,那么碳与氧化铜反应生成的气体也有多种可能?”[猜...