本试题 “根据碘与氢气反应的热化学方程式:H2(g)+I2(g)2HI(g)ΔH=–26.48kJ/mol①H2(g)+I2(s)2HI(g)ΔH=+9.48kJ/mol ②下列判断正确的是[ ]A.254g I2(g...” 主要考查您对吸热反应、放热反应
盖斯定律
化学反应热的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 盖斯定律
- 化学反应热的计算
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
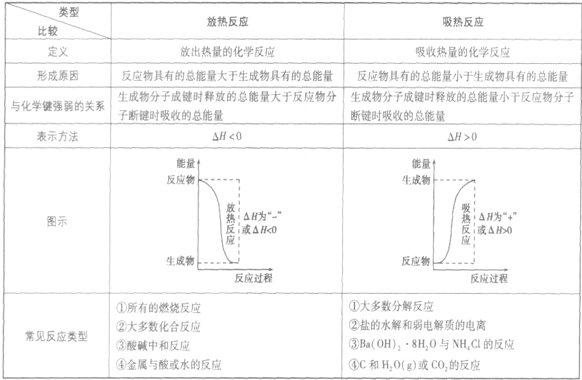
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

盖斯定律的内容:
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如: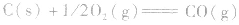 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
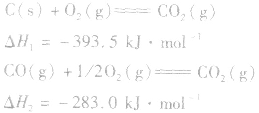
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
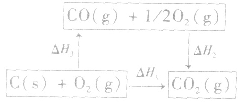
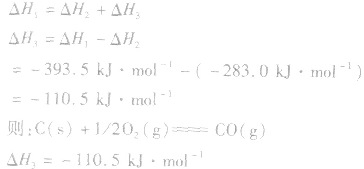
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
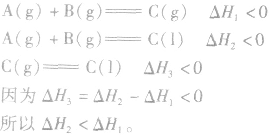
若按以下思路分析:
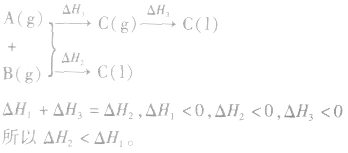
2.同一反应物状态不同时
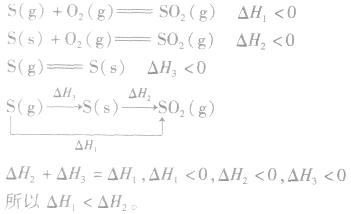
3.两个有联系的不同反应相比
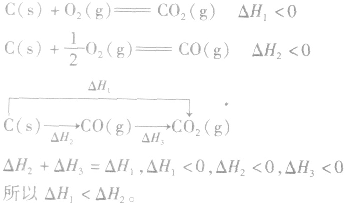
并且据此可写出下面的热化学方程式:

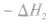
不管化学反应是一步完成还是分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一一步完成时的反应热是相同的,这就是盖斯定律。
盖斯定律的意义:
利用盖斯定律可以间接计算某些不能直接测得的反应的反应热。例如:
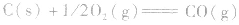 的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。
的△H无法直接测得,可以结合下面两个反应的△H,利用盖斯定律进行计算。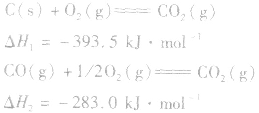
根据盖斯定律,就可以计算出所给反应的△H。分析上述两个反应的关系,即知
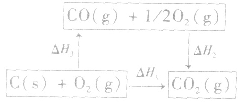
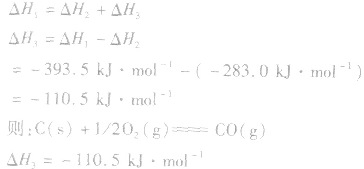
盖斯定律在反应热大小比较中的应用:
1.同一反应生成物状态不同时
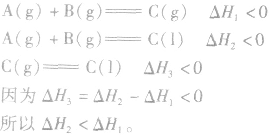
若按以下思路分析:
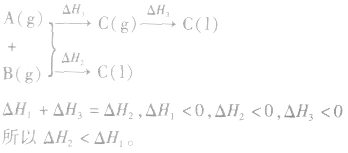
2.同一反应物状态不同时
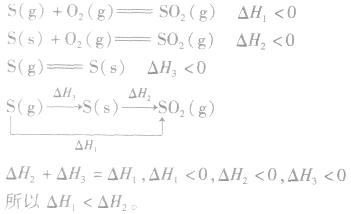
3.两个有联系的不同反应相比
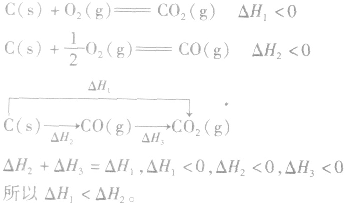
并且据此可写出下面的热化学方程式:

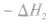
应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
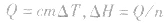
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
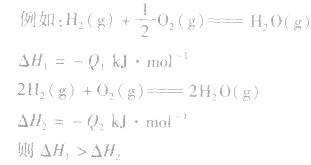
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即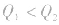 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
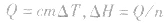
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
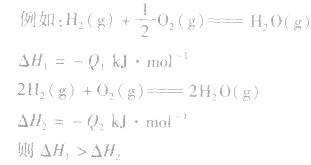
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
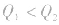 .
. 发现相似题
与“根据碘与氢气反应的热化学方程式:H2(g)+I2(g)2HI(g)Δ...”考查相似的试题有:
- 下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ)。根据上述数据回答(1)~(5)题:(1)下列物质本身具有的能量最低的是__...
- (1)如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,...
- 下列说法不正确的是( )A.需要加热才能发生的反应就一定是吸热反应B.燃料的燃烧反应都是放热反应C.化学反应的能量变化与...
- 某反应过程中体系的能量变化如图所示,下列说法错误的是[ ]A.反应过程可表示为A+BC→[A…B…C] →AB+C(反应物)(过渡态)(产...
- 已知热化学方程式:2SO2(g)+O2(g)2SO3(g);ΔH=-Q kJ/mol(Q>0)。下列说法正确的是[ ]A.相同条件下,2 mol SO2(g...
- 已知石墨所具有的总能量比金刚石所具有的总能量低.据此判断,下列说法中正确的是( )A.由石墨制备金刚石是吸热反应;石墨...
- 已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol,2NO(g)=N2(g)+2O2(g) △H= -67.8 kJ/mol,2NO2(g)=N2O4(g) △H=-56.9 kJ/mol。则以下...
- 磷单质及其化合物的有广泛应用.(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3...
- C、CO、CH4、C2H5OH是常用的燃料,它们每1mol 分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、283.0kJ、89...
- 据报道,北京奥运会“祥云”火炬燃料为丙 烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气体。(1)常温、同压下,等体积的丙烷和丁烷...