本试题 “下列有关物质分类或归纳的说法中,正确的一组是( )①分馏、干馏、裂化都是化学变化②盐酸、漂白粉、水玻璃都是混合物③植物油、直馏汽油都可与溴水反应④明矾、...” 主要考查您对化学反应和物理变化
物质的简单分类
电解质、非电解质
同分异构体
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应和物理变化
- 物质的简单分类
- 电解质、非电解质
- 同分异构体
化学变化:在化学反应中,分子破裂成原子,原子重新排列组合生成新物质的过程,称为化学反应。在反应中常伴有发光发热变色生成沉淀物等现象。
物理变化:在物理变化中没有新物质生成,一般只是物质的形状或状态发生变化。
物质变化对比:
| 物理变化 | 化学变化 | |
| 特征 | 没有新物质生成 | 有新物质生成 |
| 实质 | 构成物质的粒子间隔发生变化,物质的组成、结构没有变化,无新物质生成 | 物质的组成、结构发生变化,物质中原子重新组合,有新物质生成 |
| 关系 | 化学变化中一定有物理变化,但物理变化中一定没有化学变化 | |
(1)化学变化中常伴随着发光、发热和颜色变化,但有发光、发热或颜色变化的变化不一定是化学变化,如在常压下将氧气冷却到-184℃时,O2变成淡蓝色的液体。
(2)原子的裂变、聚变中虽有新物质形成,但它不属于中学化学变化研究的范畴。
化学反应的实质:
判断一个反应是否为化学反应的依据是反应是否生成新的物质。化学反应的实质是旧键的断裂和新键的形成。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质。
(2)纯净物:由单一物质组成的物质 注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍为纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质。
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
混合物、纯净物、单质、化合物的概念:
(1)混合物:由两种或多种物质混合而成的物质
混合物没有固定的组成,一般没有固定的熔沸点
常见特殊名称的混合物:氨水、氯水、王水、天然水、硬水、软水、盐酸、浓硫酸、福尔马林、水玻璃、爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气、合金、过磷酸钙、漂白粉、黑火药、铝热剂、水泥、铁触媒、玻璃、煤、石油、石油的各种馏分
注:由同素异形体组成的物质为混合物,如红磷和白磷。
(2)纯净物:由单一物质组成的物质
注:由同位素原子组成的物质是纯净物,如H2O和D2O混合后仍未纯净物。
(3)单质:由同种元素组成的纯净物,可分为金属单质和非金属单质
(1)金属单质:如Fe、Al、Cu等
(2)非金属单质:如Cl2、O2、S等
(4)化合物:由不同种元素组成的纯净物。从不同角度可见化合物分为离子化合物,共价化合物,电解质和非电解质,有机化合物和物质化合物,酸碱盐和氧化物等。
(5)酸、碱、盐、氧化物
①酸:电离理论认为电解质电离出阳离子全部是H+的化合物
常见的强酸:HClO4 H2SO4 HCl HNO3等
常见的弱酸:H2SO3 H3PO4 HF H2CO3 CH3COOH等
②碱:电离理论认为电解质电离出阴离子全部是OH-的化合物
常见强碱:NaOH KOH Ba(OH)2 Ca(OH)2等
常见弱碱:NH3·H2O Al(OH)3 Fe(OH)3等
③盐:电离时生成金属阳离子(NH4+)和酸根离子的化合物,可分为:正盐、酸式盐、碱式盐、复盐
a正盐:Na2SO4 Na2CO3 (NH4)2SO4 等
b酸式盐:NaHCO3 NaHSO4 NaH2PO4 Na2HPO4等
c碱式盐:Cu(OH)2CO3 Mg(OH)2CO3等
d复盐:KAl(SO4)2·H2O (NH4)2Fe(SO4)2·6H2O等
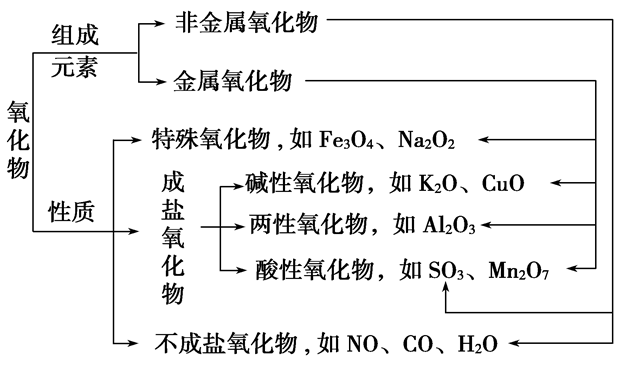
(6)氧化物:由两种元素组成,其中一种元素是氧的化合物
①按组成分:
金属氧化物:Na2O Al2O3 Fe3O4等
非金属氧化物:NO2 SO2 CO2等
②按性质分:
不成盐氧化物:CO NO等
酸性氧化物:CO2 SO2等
碱性氧化物:Na2O CuO等
两性氧化物:Al2O3 ZnO等
过氧化物:Na2O2 H2O2等
超氧化物:KO2等
特殊例子提醒:
(1)胆矾、明矾等结晶水合物是纯净物,不是物质和水的混合物。
(2)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
(3)酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
(4)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、CuO)。
(5)与水反应生成酸的氧化物不一定是酸性氧化物(如NO2);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2)。
无机物分类:

氧化物的分类:
1.电解质和非电解质在水溶液里或熔融状态下能导电的化合物,叫做电解质。在水溶液里和熔融状态下都不导电的化合物,叫做非电解质。
2.电解质和非电解质的比较

说明(1)电解质、非电解质均是化合物。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质是一定条件下本身电离而导电的化合物。CO2、SO2、SO3、NH3溶于水后也导电,但是与水反应生成的新物质电离而导电的,不是本身电离而导电的,故属于非电解质。
(4)电解质的强弱由物质的内部结构决定,与其溶解度无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然溶解度很小,但溶解的部分是完全电离的,所以是强电解质。
(5)电解质不一定导电,非电解质一定不导电;导电的物质不一定是电解质,不导电的物质不一定是非电解质。
同分异构现象和同分异构体:
1.概念:化合物具有相同的分子式.但结构小同,因而产生了性质上的差异,这种现象叫同分异构现象。具有同分异构现象的化合物互为同分异构体。
2.同分异构体的基本类型
(1)碳链异构:指的是分子中碳骨架不同而产生的同分异构现象。如所有的烷烃异构都属于碳链异构。
(2)位置异构:指的是分子中官能团位置不同而产生的同分异构现象。如l一丁烯与2一丁烯、l一丙醇与2一丙醇、邻二甲苯与间二甲苯及对二甲苯。
(3)官能团异构:指的是有机物分子式相同,但具有不同官能团的同分异构体的现象。常见的官能团异构关系如下表所示: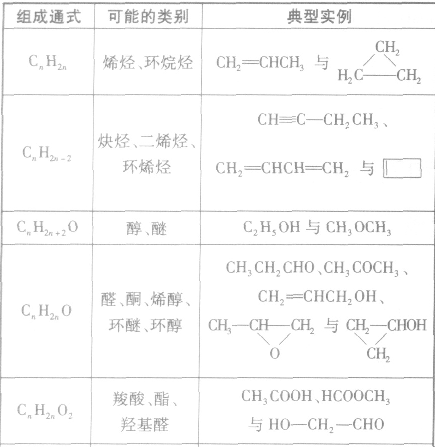
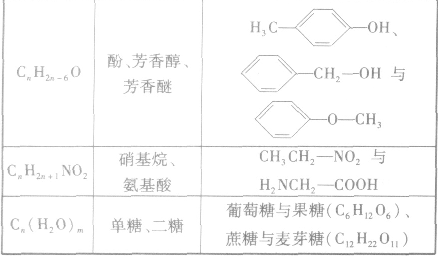
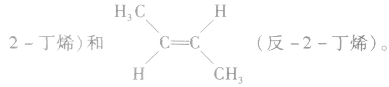
(4)顺反异构:由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象。两个相同的原子或原子团排列在双键的同一侧的称为顺式结构;两个相同的原子或原子团排列在双键的两侧的称为反式结构。如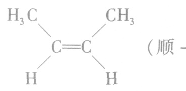
同分异构体的写法:
1.烷烃的同分异构体的写法烷烃只存在碳链异构,其书写技巧一般采用“减碳法”,可概括为“两注意,四句话”。
(1)两注意:①选择最长的碳链为主链;②找出主链的中心对称线。
(2)四句话:主链由长到短、支链由整到散,位置由心到边,排布邻、间、对。
例如,C6H14的同分异构体可按此法完整写出(为了简便,在所写结构式中删去了氢原子): 
2.烯烃的同分异构体的写法分子组成符合CnH2n的烃除烯烃外,还有环烷烃 (n≥3),并且烯烃中双键的位置不同则结构不同,有的烯烃还存在顺反异构,所以烯烃的同分异构体比烷烃复杂得多。以C5H10为例说明同分异构体的写法: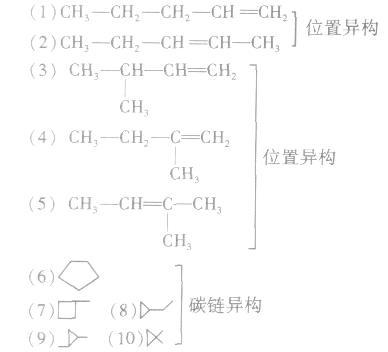
共有5种烯烃,其中(2)还存在顺反异构体,5种环烷烃,共计11种。
3.苯的同系物的同分异构体的写法由于苯环上的侧链位置不同,可以形成多种同分异构体。以C8H10为例写出其属于苯的同系物的同分异构体:
判断同分异构体数目的方法:
1.碳链异构和位置异构:先摘除官能团,书写最长碳链,移动官能团的位置;再逐渐减少碳数,移动官能团的位置。判断分子式为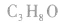 的醇的同分异构体数目:
的醇的同分异构体数目:
先摘除官能团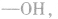 剩余
剩余 和
和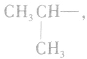 可见有两种属于醇的同分异构体;
可见有两种属于醇的同分异构体;
判断分子式为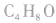 的属于醛的同分异构体数目:
的属于醛的同分异构体数目:
先摘除官能团 剩余
剩余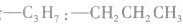 和
和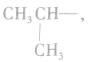 可见有两种属于醛的同分异构体。
可见有两种属于醛的同分异构体。
分子式符合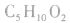 的羧酸的同分异构体数目:
的羧酸的同分异构体数目:
先摘除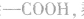 剩余
剩余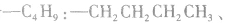
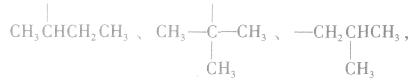 可 见有4种属于酸的同分异构体。
可 见有4种属于酸的同分异构体。
2.官能团衍变:先判断官能团的类别异构,再分别判断同种官能团的异构数目。例如分子式符合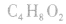 的同分异构体:符合羧酸和酯的通式,属于酸的2种(即摘除
的同分异构体:符合羧酸和酯的通式,属于酸的2种(即摘除 后剩余
后剩余 ),这样一个羧基又可以变为一个醛基和一个羟基,又可以衍变出含有两种不同含氧官能团(含有羟基和醛基)的异构体;属于酯的同分异构体:可以按羧酸和醇的碳数先分类,即酯由一个碳的酸(甲酸)和3个碳的醇(1一丙醇、2一丙醇)得到,酯由2个碳的酸(乙酸)和2个碳的醇(乙醇)得到,酯由3个碳数的酸(丙酸)和1个碳的醇(甲醇)得到,这样就会写出4种酯。
),这样一个羧基又可以变为一个醛基和一个羟基,又可以衍变出含有两种不同含氧官能团(含有羟基和醛基)的异构体;属于酯的同分异构体:可以按羧酸和醇的碳数先分类,即酯由一个碳的酸(甲酸)和3个碳的醇(1一丙醇、2一丙醇)得到,酯由2个碳的酸(乙酸)和2个碳的醇(乙醇)得到,酯由3个碳数的酸(丙酸)和1个碳的醇(甲醇)得到,这样就会写出4种酯。
3.苯环上的位置变换:例如分子式符合 的芳香酯的同分异构体:
的芳香酯的同分异构体: 
4.判断取代产物种类(“一”取代产物:对称轴法; “多”取代产物:一定一动法;数学组合法)。
5.替代法:例如二氯苯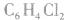 有3种,则四氯苯也为3种(将H替代C1);又如CH4的一氯代物只有一种,新戊烷C(CH3)4的一氯代物也只有一种。
有3种,则四氯苯也为3种(将H替代C1);又如CH4的一氯代物只有一种,新戊烷C(CH3)4的一氯代物也只有一种。
6.对称法(又称等效氢法):等效氢法的判断可按下列三点进行:
(1)同一碳原子上的氢原子是等效的;
(2)同一碳原子所连甲基上的氢原子是等效的;
(3)处于镜面对称位置上的氢原子是等效的(相当于平面成像时,物与像的关系)。
烃的一取代物的数目等于烃分子中等效氢的种数。
与“下列有关物质分类或归纳的说法中,正确的一组是( )①分馏、...”考查相似的试题有:
- 下列叙述中正确的是 A.含氧元素的化合物称为氧化物B.由一种元素组成的物质一定是单质C.单质只能用置换反应制取D.纯碱从物...
- 下列叙述中正确的是( )A.CO2是酸性氧化物B.由一种元素组成的物质一定是单质C.单质只能用置换反应制取D.含氧元素的化合...
- ①NaOH溶液 ②铜丝 ③液态HCl ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦CO2⑧熔融NaCl ⑨蔗糖晶体 ⑩酒精上述状态下可导电的是_______,属于非电解质的...
- NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是( )A.钠的化合物B.可与硝酸反应C.可溶于...
- 下列物质中不属于电解质的是( )A.Cl2B.HNO3C.NaOHD.NaCl
- 下列有关分类的说法正确的是( )A.根据物质所含元素种类可将其分为单质和化合物B.根据化合物的水溶液是否可以导电,将其分...
- 下列各组物质的水溶液均能导电,但前者属是电解质、后者属于非电解质的是( )A.CuSO4、HClB.CH3COOH、Na2OC.NaClO、NH4HC...
- 已知化合物A (C4Si4H8)与立方烷(C8H8)的分子结构相似如下图 ,则C4Si4H8的二氯代物的同分异构体数目为[ ]A.3B.4C.5D.6
- 下列各物质中,属于同分异构体的是[ ]A.石墨与金刚石B.C.D.
- 下列有机物中,一氯取代物最多的是( )A.B.C.D.