本试题 “海洋是卤素资源的宝库,如99%以上的溴来自海洋,碘也主要分布在海洋中。(1)卤素原子的最外层电子的轨道表示式可写为_____________,其中氟原子的核外电子的运...” 主要考查您对轨道表示式
元素的性质
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 轨道表示式
- 元素的性质
轨道表示式:
每一个原子轨道用1个方框表示,在方框内标明基态原子核外电子分布的式子称为轨道表示式。如:
Na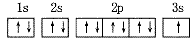
C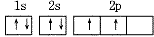
每一个原子轨道用1个方框表示,在方框内标明基态原子核外电子分布的式子称为轨道表示式。如:
Na
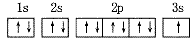
C

元素的性质:
由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。
碱金属元素的性质:
(1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强
(2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
(3)化合物性质
同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。
注: ①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。 ②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
(2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
由于核外电子排布的周期性变化,使元素表现出不同的性质。元素性质与原子结构密切相关,主要与原子核外电子排布,特别是最外层电子数有关。
碱金属元素的性质:
(1)元素性质同:均为活泼金属元素,最高正价均为+1价异:失电子能力依次增强,金属性依次增强
(2)单质性质同:均为强还原性(均与O2、X2等非金属反应,均能与水反应生成碱和氢气。),银白色,均具轻、软、易熔的特点异:与水(或酸)反应置换出氢依次变易,还原性依次增强,密度趋向增大,熔沸点依次降低,硬度趋向减小
(3)化合物性质
同:氢氧化物都是强碱。过氧化物M2O2具有漂白性,均与水反应产生O2;异:氢氧化物的碱性依次增强。
注: ①Li比煤油轻,故不能保存在煤油中,而封存在石蜡中。 ②Rb,Cs比水重,故与水反应时,应沉在水底。③与O2反应时,Li为Li2O;Na可为Na2O,Na2O2;K,Rb,Cs的反应生成物更复杂。
卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2
 HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。
HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中溶解度较大,相似相溶)。 (2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
发现相似题
与“海洋是卤素资源的宝库,如99%以上的溴来自海洋,碘也主要分布...”考查相似的试题有:
- (4分)A、B、C、D四种气体,都是大气的污染物。国家环境保护法严格禁止把这类气体大量排入空气中,工业上通常都用碱液加以吸收...
- 只用试管和胶头滴管而不用其它试剂无法区分的一组溶液是( )A.KOH溶液和AlCl3溶液B.Na2CO3溶液和盐酸C.MgCl2溶液和氨水D...
- C、N、S都是重要的非金属元素。下列说法正确的是A.三者对应的氧化物均为酸性氧化物B.三者的单质直接与氧气反应都能生成两种...
- 在下列物质转化关系中,反应的条件和部分产物已略去。其中A为常用的溶剂,B为常见的有色气体单质。回答下列问题:Ⅰ.若甲、乙...
- 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是选项陈述Ⅰ陈述Ⅱ判断A盛放氢氧化钠溶液的试剂瓶用橡胶塞...
- 第三周期元素R,它的原子最外电子层上达到饱和所需电子数小于次外层和最内层电子数之差,但等于最内层电子数的正整数倍。下列...
- 下列关于元素或物质的性质说法正确的是( )A.氯气和二氧化硫均可以使品红溶液褪色,但将溶有二氧化硫的品红溶液加热后又复...
- 砹(At)是原子序数最大的卤族元素,推测砹及砹的化合物最不可能具有的性质有[ ]A.砹是有色固体B.砹易溶于有机溶剂C.HAt ...
- 下列根据实验操作和现象所得出的结论正确的是选项实验操作实验现象结论A向溴水中通入SO2气体溶液褪色SO2具有漂白性B向淀粉水...
- 下列各组物质中,不是按(“→”表示一步完成)关系相互转化的是( )选项ABCDaFeSiO2Al(OH)3HNO3bFeCl3Na2SiO3NaAlO2NOcFeCl2H2Si...