本试题 “某有机物中可能有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种,在鉴定时有下列现象,则下列结论正确的是[ ]①有银镜反应②加入新制的氢氧化铜悬浊液,沉...” 主要考查您对醇的通性
乙酸
酯
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 醇的通性
- 乙酸
- 酯
醇:
醇的定义:羟基跟烃基或苯环侧链上的碳原子直接相连的化合物叫做醇。
说明:在同一个碳原子上存在两个或多个羟基的多元醇,羟基连在碳碳双键或碳碳三键的不饱和碳原子上的醇,都不能稳定存在。
醇的性质:
1.醇的物理性质饱和一元醇的沸点比其相对分子质量接近的烷烃或烯烃的沸点高。这是因为一个醇分子中羟基上的氢原子可与另一个醇分子中羟基上的氧原子相互吸引形成氢键,增强了醇分子间的相互作用。
2.醇的化学性质
(1)羟基的反应
①取代反应
在加热的条件下,醇与氢卤酸(如HCl、HBr、HI)发生取代反应生成相应的卤代烃和水,例如: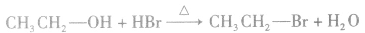
在浓硫酸作催化剂及加热的条件下,醇可以发生分子间的取代反应生成醚和水,例如: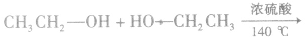
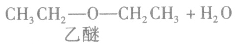
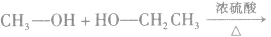

说明a.由醇生成醚的反应又叫做脱水反应或分子间脱水反应。
b.在醇生成醚的反应中,浓硫酸的作用是作催化剂和脱水剂。温度是醇脱水生成醚的必要条件之一,若温度过低,反应速率很慢或不能反应;若温度过高,反应会生成其他物质。
②消去反应
含β—H的醇,在一定条件下发生消去反应生成烯烃和水,例如:
说明a.由醇生成烯烃的反应又叫做脱水反应或分子内脱水反应。
b.从分子组成与结构的方面来说,脱水生成烯烃的醇分子必须含有β一H,如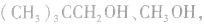 由于分子中没有β—H,不能脱水生成烯烃。
由于分子中没有β—H,不能脱水生成烯烃。
c.在醇生成烯烃的反应中,浓硫酸的作用是作催化剂和脱水剂。
d.人们通常把和官能团相连的碳原子称为α一C 原子.α—C原子上的氢原子称为α—H原子;依次称为β一C原子,β—H原子……
(2)羟基中氢原子的反应
①与活泼金属反应
由于氧元素与氢元素电负性的差异较大,羟基中氢氧键的极性比较强,容易断裂,所以羟基中的氢原子比较活泼,能与钠、钾、镁、铝等金属发生反应。例如,乙醇可以与金属钠反应生成乙醇钠和氢气。
②酯化反应
在一定条件下,醇羟基中的氢原子能够被羧酸分子中的酰基( )取代生成酯和水。
)取代生成酯和水。
例如: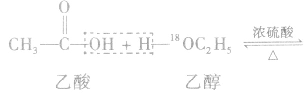

说明a.该类反应由于生成了酯,所以叫做酯化反应。从物质分子组成形式变化的角度来说,该反应又属于取代反应。
b.在乙醇与乙酸生成乙酸乙酯的反应中,利用氧同位素(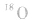 )示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素(
)示踪法对乙醇分子中的氧原子进行标记,通过对生成物的检测,发现产物乙酸乙酯中含有氧的同位素(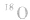 )。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
)。这说明,酯化反应中脱掉羟基的是羧酸,脱掉氢原子的是醇。
c.醇跟羧酸发生的酯化反应为可逆反应,具有反应速率慢和向右进行程度小的特点。加入浓硫酸的目的(浓硫酸的作用)有两个:一是作催化剂,提高化学反应速率;二是作吸水剂,通过吸收反应生成的水促使反应向生成乙酸乙酯的方向移动,提高乙酸与乙醇的转化率。
d.醇还能与硫酸、硝酸、磷酸等无机含氧酸发生酯化反应,生成的酯统称为无机酸酯。
(3)氧化反应大多数醇可以燃烧,完全燃烧时生成二氧化碳和水。醇也可以被催化氧化。例如: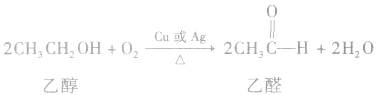
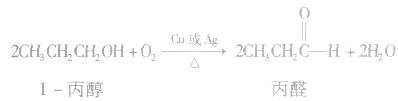
说明a.在醇的催化氧化反应中,醇分子中有2 个α一H时,醇被氧化为醛;醇分子中有1个α—H时,醇被氧化为酮;醇分子中没有α一H时,醇不能发生上述催化氧化反应。
b.乙醇也能被KMnO4酸性溶液、K2Cr2O7(重铬酸钾)酸性溶液氧化。
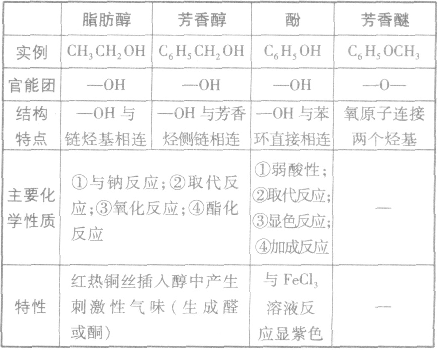
脂肪醇、芳香醇、酚和芳香醚的比较:
羟基氢原子活泼性比较:
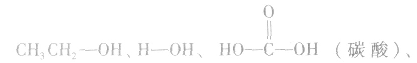
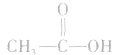 均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下:
均有羟基,南于这些羟基连接的基团不同,羟基上氢原子的活泼性也就不同,现比较如下: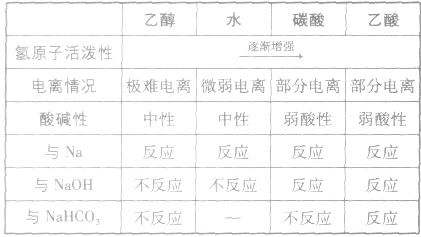
乙酸分子的组成与结构:
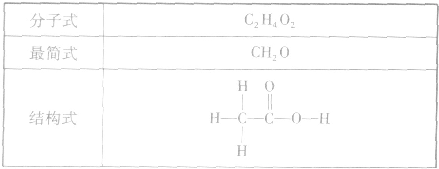
酸从结构上可以看成是甲基和羧基(-COOH)相连而成的化合物。乙酸的官能团是一COOH。
乙酸的性质:
俗称醋酸,具有强烈刺激性气味的无色液体。沸点117.9℃,熔点16.6℃。温度低于熔点时,乙酸凝结成类似冰一样的晶体,纯净的乙酸称为冰醋酸。乙酸溶于水和乙醇。
(1)乙酸的酸性:乙酸的酸性促使它还可以与碳酸钠、氢氧化铜、苯酚钠等物质反应。
2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O
2CH3COOH+Cu(OH)2=Cu(CH3COO)2+2H2O
CH3COOH+C6H5ONa=C6H5OH(苯酚)+CH3COONa
(2)乙酸与金属反应:
2Na+2CH3COOH→2CH3COONa+H2↑
(3)乙酸的酯化反应:
在浓硫酸作用下乙酸和乙醇反应酯化反应
CH3COOH+CH3CH2OH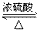 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
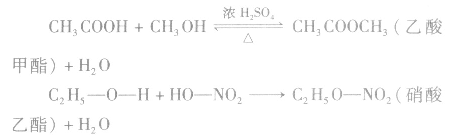
1.概念及通式:
酸(羧酸或无机含氧酸)和醇起反应生成的一类化合物叫酯。如:
酯的通式为
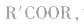 官能团是
官能团是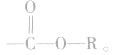 饱和一元羧酸和饱和一元醇形成的酯的通式为
饱和一元羧酸和饱和一元醇形成的酯的通式为 (n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。
(n≥2),所以这种酯与碳原子数相同的饱和一元羧酸及羟基醛互为同分异构体,与多1个碳原子的饱和一元醇的相对分子质量相等。2.分类
根据生成酯的酸的不同,酯可分为有机酸酯和无机酸酯,通常所说的酯是指有机酸(羧酸)酯。
3.书写及命名——某酸某酯
根据生成酯的酸和醇对酯进行命名:如:

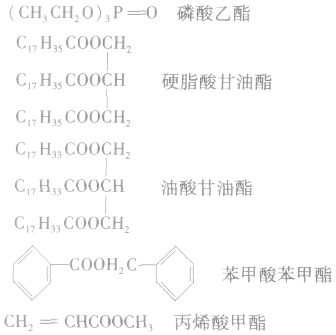
4.酯的存在酯类广泛存在于自然界中,如苹果里含有戊酸戊酯,香蕉里含有乙酸异戊酯等。
酯的性质:
1.酯的物理性质
低级酯是具有芳香气味的液体,密度一般小于水,并难溶于水,易溶于有机溶剂。
2.酯的化学性质
在酸或碱催化的条件下,酯可以发生水解反应,能得到相应的酸和醇。酯在酸性条件下的水解反应是可逆反应。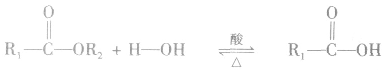
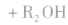
酯在碱性条件下的水解程度大于在酸性条件下的水解程度,其主要原因是在碱性条件下,酯水解生成的羧酸可以与碱发生反应,使羧酸浓度减小,即减小了生成物的浓度,化学平衡向正反应方向移动,使酯的水解程度增大。
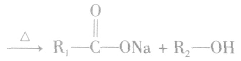
3.酯的用途酯具有广泛的用途。很多香精、药物本身就是酯。例如,广泛用于农业生产和家庭除虫的低毒高效杀虫药拟除虫菊酯就是一种酯,某些抗生素如红霉素为大环内酯类抗生素,也属于酯。日常生活中的饮料、糖果和糕点等常使用酯类物质作为香料。液态的酯可用作有机溶剂。
酯化反应的规律归纳:
1.酯化反应中量的变化
(1)酯化反应发生时,每有1mol酯基“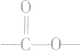 ”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
”生成,必生成1molH2O。根据质量守恒有:反应物巾各元素原子数=生成物中各元素原子数;m(酸)+m(醇)=m(酯)+m(H2O)。
2.酯化反应前后碳链结构的变化规律
在下列一系列变化中,分子中的碳链结构不变:醇 醛
醛 羧酸
羧酸 酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
酯,酯键两侧的碳骨架仍保持着醇的碳架和羧酸的碳架。醇与它自身氧化成的羧酸反应生成的酯,酯键两侧碳骨架相同。
3.酯化反应的反应条件
酯化反应是可逆反应,逆反应是酯的水解。羧酸和醇的酯化反应速率很慢,冈此,酯化反应通常要在加热并加催化剂(浓硫酸)的条件下进行。之所以用浓硫酸而不用稀硫酸是因为浓硫酸除起催化作用外,还可作吸水剂吸收酯化反应生成的水,有利于反应向生成酯的方向进行。酯化反应巾的浓硫酸,可用浓磷酸
与“某有机物中可能有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一...”考查相似的试题有:
- 2006年5月15日,国家食品药品监督管理局通报查处了齐齐哈尔第二制药有限公司使用工业溶剂二甘醇(HO―CH2―CH2―O―CH2―CH2―OH)...
- 既可以发生消去反应,又能被氧化成醛的物质是( )A.2—甲基—1—丁醇B.2,2—二甲基—1—丁醇C.2—甲基—2—丁醇D.2,3—二甲基—2—...
- 下列关于实验原理或操作的叙述中,不正确的是( )A.从碘水中提取单质碘时,不能用无水乙醇代替CCl4B.可用新制的Cu(OH)2...
- 下列叙述正确的是[ ]① 加热能杀死甲型H1N1流感病毒是因为病毒的蛋白质受热变性② 使1mol乙烯与氯气发生完全的加成反应和取代反...
- 下列做法中用到物质氧化性的是[ ]A.明矾净化水B.纯碱除去油污C.臭氧消毒餐具D.食醋清洗水垢
- (16分)2010年美、日三位科学家因钯(Pd)催化的交叉偶联反应获诺贝尔化学奖。一种钯催化的交叉偶联反应如下:(、为烃基或...
- 据某媒体报道:国家质检总局2011年12月24日公布了对200种液体乳产品质量的抽查结果。发现蒙牛、长富纯牛奶两种产品黄曲霉毒素...
- 实验室用下图所示的装置制取乙酸乙酯。(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,其操作步骤为 ___________ _...
- 胆固醇是人体必需的生物活性物质,分子式为C25H45OH。已知某种胆固醇酯是液晶材料,分子式为C32H50O2。则生成这种胆固醇酯的...
- 下列关于阿司匹林()的说法错误的是A.阿司匹林属于羧酸类有机物B.阿司匹林有解热镇痛的作用C.服用阿司匹林可能出现不良反...