本试题 “已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO42-。某温度下向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中不...” 主要考查您对水电离的影响因素
溶液的酸碱性
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 水电离的影响因素
- 溶液的酸碱性
影响水电离平衡的因素:
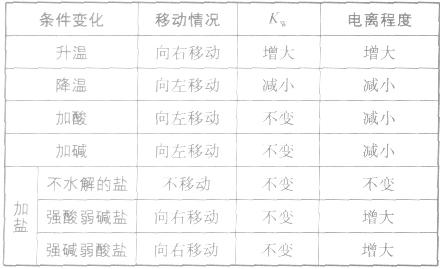
溶液的酸碱性:
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
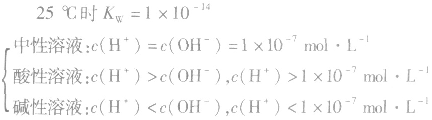
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
(1)pH=-lg[c(H+)],在溶液的c(H+)很小时,用pH来表示溶液的酸度。
(2)pH越大,c(H+)越小,c(OH-)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
(3)pH的范围:0~14
(4)溶液酸碱性判断:
当c(H+)>c(OH-)时,溶液呈酸性;
当c(H+)>=c(OH-)时,溶液呈键性;
当c(H+)<c(OH-)时,溶液呈中性。
(5)关于pH相同的酸(含强酸和弱酸)
①溶液中c(H+)相等(填“相等”或“不等”)。
②溶液中溶质的物质的量的浓度:强酸<弱酸(填“>”或“<”)。
③耗碱规律:pH和溶液体积均相同的HCl、H2SO4、CH3COOH与碱完全反应时,消耗碱物质的量最多的是CH3COOH。
④稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m,强酸中c(H+)变为原来的1/m,但弱酸中c(H+)减小小于(填“大于”或“小于”)m倍,故稀释后弱酸酸性强于强酸。
溶液的pH:
1.定义:溶液里H+的物质的量浓度的负对数叫做pH。
2.表达式:
3.含义: pH越大,c(H+)越小,c(O-一)越大,酸性越弱,碱性越强。pH越小,c(H+)越大,c(OH-)越小,酸性越强,碱性越弱。
4.适用范围:
c(H+)很小时,用pH来表示溶液的酸碱度更方便。所以,pH适用于酸、碱的稀溶液
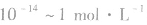 之间],pH取值范刚为0~14。
之间],pH取值范刚为0~14。
5.溶液的酸碱性和pH: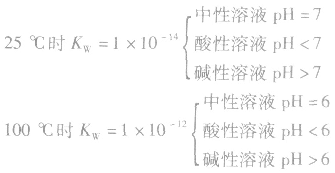
发现相似题
与“已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO42-。某...”考查相似的试题有:
- MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化。如图所示。下列叙述中正确的是 A.ROH是一种弱碱B.在x点,c(M+) = c(R...
- 室温时,向10mL的醋酸稀溶液中逐滴滴入NaOH稀溶液至过量,有关叙述正确的是A.实验过程中水的电离程度的变化是先增大后减小B...
- 有关下列两种溶液的说法中,正确的是( )溶液①:0.2mo1•L-1CH3COONa溶液;溶液②:0.1mo1•L-1H2SO4溶液.A.相同温度下,溶液...
- 下列属于水解离子方程式且正确的是A.HCO3-+ H2OH3O++ CO32-B.NH3+ H2ONH4++ OH-C.CO32-+2H2OH2CO3+ 2OH-D.Al3++3H2...
- 25℃时,水中存在电离平衡:H2OH++OH-△H>0.下列叙述正确的是( )A.将水加热,Kw增大,pH不变B.向水中加入少量NaHSO4固体...
- 下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是( )A.CH3COOHB.Al2(SO4)3C.NaHSO4D.Na2CO3
- 将0.5mol的下列物质溶于500ml水中,,含阴离子数目最多的是( )A.CaCO3B.CH3COONaC.NH3D.Na2SO3
- 常温下,0.1 mol·L-1氨水溶液中=1×10-8,下列叙述错误的是A.该溶液中氢离子的浓度:c(H+) = 1×10-9mol·L-1B.0.1 mol·L-1...
- 浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液,②氢氧化钠溶液 ③醋酸钠溶液,下列说法不正确的是( )A.①和②等体积混合后的溶...
- 下列溶液一定呈中性的是[ ]A.c(H+)=c(OH-)=10-6mol/L溶液B.pH=7的溶液C.使石蕊试液呈紫色的溶液D.酸与碱恰好完全反应生成...