收集方法及装置:
a.排水集气法:适用于收集不溶于水,不与水反应的气体。装置如下:如采用第二个装置,气体应短进长出。

b.向上排空气法:适用于收集密度比空气大不与空气反应的气体,装置如下:如采用第二个装置,气体应长进短出。

c.向下排空气法:适用于收集密度比空气小不与空气反应的气体。装置如下:如采用第二个装置,气体应短进长出。
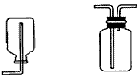 气体净化:
气体净化:
装置:
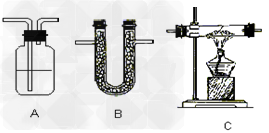
 气体干燥:
气体干燥:
(1)干燥原则:
干燥剂只能吸收气体中含有的水分而不能与气体发生反应。
①酸性干燥剂不能干燥碱性气体。
②碱性干燥剂不能干燥酸性气体。
③具有强氧化性的干燥剂不能干燥具有强还原性的气体。注意H2、CO、SO2虽具有还原性,但可用浓H2SO4干燥。
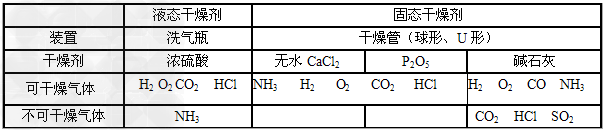
(2)常见物质干燥
实验室制取甲烷(CH4):
(1)反应原理:CH
3COONa+NaOH
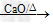
CH
4+Na
2CO
3
(2)发生装置:固+固
气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法/向下排空气法
(5)尾气处理:无
(6)检验方法:①点燃,淡蓝色火焰,燃烧产物是H
2O和CO
2
实验室制取一氧化氮(NO):
(1)反应原理:3Cu+8HNO
3(稀)==3Cu(NO
3)
2+2NO↑+4H
2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:排水集气法
(5)尾气处理:收集法(塑料袋)
(6)检验方法:无色气体,暴露于空气中立即变为红棕色
实验室制取二氧化氮(NO2):
(1)反应原理:Cu+4HNO
3(浓)==Cu(NO
3)
2+2NO
2↑+2H
2O
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:碱液吸收 (3NO
2+H
2O==2HNO
3+NO;NO+NO
2+2NaOH===2NaNO
2+H
2O)
实验室制取氯化氢(HCl):
(1)反应原理:2NaCl+H
2SO
4
Na
2SO
4+2HCl?
(2)发生装置:固+液→气
(3)净化方法:浓硫酸(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:水(防倒吸装置)
(6)检验方法:①能使湿润的蓝色石蕊试纸变红 ②靠近浓氨水冒白烟
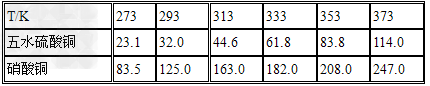
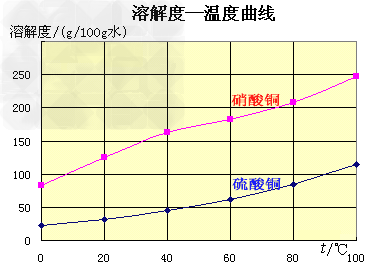
五水硫酸铜的制备:
(1)实验原理:铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu
2+,Cu
2+与SO
42-结合得到硫酸铜: Cu+2HNO
3+H
2SO
4====CuSO
4+2NO
2+2H
2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
(2)实验步骤
①称量1.5g铜屑,灼烧至表面呈现黑色,冷却;
②加5.5mL3mol/L硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol/L硫酸,0.5mL浓硝酸;
③铜近于完全溶解后,趁热倾滗法分离;
④水浴加热,蒸发浓缩至结晶膜出现;
⑤冷却、过滤;
⑥粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤;
⑦滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。
⑧称重,计算产率。
实验室制取硫化氢(H2S):
(1)反应原理:FeS+2HCl→H
2S↑+FeCl
2
(2)发生装置:固+液→气(启普发生器)
(3)净化方法:饱和NaHS(除HCl),固体CaCl
2(除水蒸气)
(4)收集方法:向上排空气法
(5)尾气处理:CuSO
4溶液或碱液吸收(H
2S+2NaOH==Na
2S+H
2O或H
2S+NaOH==NaHS+H
2O)
(6)检验方法:①湿润的蓝色石蕊试纸变红 ②湿润的醋酸试纸黑