本试题 “工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下反应体系中各组分的部分性质见下表回答下列问题...” 主要考查您对化学平衡常数
合成氨(人工固氮)
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡常数
- 合成氨(人工固氮)
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
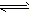 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: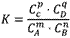
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
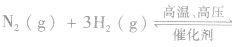


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
1.定义:氮的固定是指将游离态的氮转化为化合态氮的方法。
2.方法:氮的固定主要方法有:
(1)人工合成氨 :化学固氨法。其条件要求高、成本高、转化率低、效率低。
(2)根瘤菌,生物固氨。常温常压下进行。成本低、转化率高、效率高。
3.工业应用:模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并创造崭新的化学工艺过程。 二、合成氨的反应原理
1.加热试管中的铁丝绒至红热后注入氢气和氨气的混合气体,可以看到湿润的PH试纸变蓝色
2.用氢 气和氨气合成氨的反应式是
N2+3H2
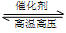 2NH3,属放热反应。
2NH3,属放热反应。 3.工业上,采用以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件下合成氨。
(1)催化剂的主要作用:成千上万倍地加快化学反应速率,缩短达平衡的时间,提高日产量。
(2)合成氨的适宜条件:以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件
(3)选择适宜生产条件的原则:有较高的反应速率和平衡转化率,能最大限度地提高利润。
(4)合成氨生产时,不采用尽可能高的压强,通常采用10MPa~30MPa 的压强,否则会增大设备的动力要求,增大成本。
(5)合成氨的反应为放热反应,降低温度促使平衡向有移动,有利于N2、H2转化为NH3;但降温必然减缓了反应速率,影响单位时间产率。生产中将二者综合考虑,既要保证N2、H2的转化率,又要保证较快的反应速率,只能选择适中的温度400~500℃左右。应注意该温度为催化剂活化温度,低于此温度,催化剂不起作用。
(6)催化剂是影响反应速率的几个因素中,对反应速率影响程度最大的。
催化剂的特点:
①选择性:不 同的反应选择不同的催化剂,如合成氨选择了铁触媒。每种催化剂都是对特定的反应有催化作用,并非能改变任何化学反应的速率。
②灵敏性:催化剂中混入杂质,常常会失去催化作 用,称催化剂“中毒”,因此 反应气体进入反应器前必须净化。 ③催化剂只有在活化温度以上才能起催化作用,如铁触媒活化温度为400~500℃,因此该温度为合成氨的适宜温度。
人工固氮技术——合成氨:
1.生产原理
2.合成氨的基本生产过程
(1)原料气的制备要实现合成氨的工业化生产,首先要解决氢气和氮气的来源问题。
①氮气的制备合成氨所需要的氮气都取自空气。从空气中制取氮气通常有两种方法:一是将空气液化后蒸发分离出氧气而获得氮气;二是将空气中的氧气与碳作用生成二氧化碳,再除去二氧化碳得到氮气。
②氢气的制备氢气主要来源于水和碳氢化合物。氢气的制取有下表中的几条途径。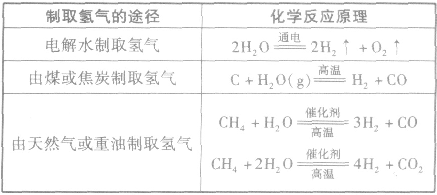
(2)原料气的净化
原料气的净化就是除去原料气中的杂质。在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨所用的催化剂“中毒”(所谓“中毒”即是催化剂失去催化活性),所以必须除去。原料气净化的主要目的是防止催化剂“中毒”。
(3)氨的合成与分离
①氨的合成工业合成氨的主要设备是合成塔。将净化后的原料气经过压缩机压缩后输人合成塔,经过下列化学反应合成氨: 
②氨的分离从合成塔出来的混合气体,通常约含15%(体积分数)的氨。为了使氨从未反应的氮气和氢气里分离出来,要把混合气体通过冷凝器使氨液化,然后在气体分离器里把液态氨分离出来导入液氨贮罐。南气体分离器出来的气体,经过循环压缩机,再送到合成塔中进行反应。
3.合成氨适宜条件的选择
外加条件要尽可能加快反应速率,提高反应物的转化率.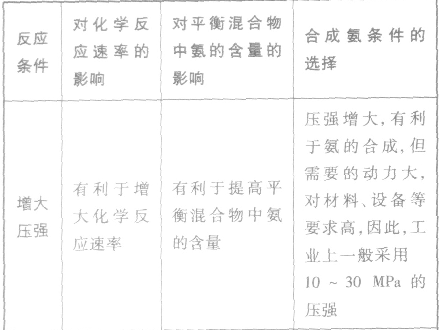
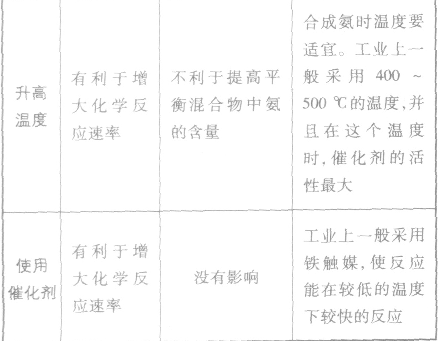
4.合成氨的环境保护
随着环境保护意识的增强,以及相关的法律、法规的严格实施,合成氨生产中可能产生的“三废”的处理越来越成为技术改造的重要问题。
(1)废渣
主要来自造气阶段,特别是以煤为原料而产生的煤渣,用重油为原料产生的炭黑等,现在大都将它们用作建材和肥料的原料。
(2)废气
主要是H2S和CO2等气体。对H2S气体的处理,先后采用了直接氧化法(选择性催化氧化)、循环法(使用溶剂将其吸收浓缩)等回收技术。对CO2 的处理,正在不断研究和改进将其作为尿素和碳铵生产原料的途径。
(3)废液
主要是含氰化物和含氨的污水。目前,处理含氰化物污水主要有生化、加压水解、氧化分解、化学沉淀、反吹回炉等方法;处理含氨废水多以蒸馏的方法回收氨达到综合利用的目的,对浓度过低的含氨废水,可用离子交换法治理。
与“工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)2...”考查相似的试题有:
- 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)NH3(g)+HI(g)②2HI(g)H2(g)+I2(g) 达到平衡时,c(H2)=0.5mol...
- 一定条件下反应A2(g)+B2(g)2AB(g)达到平衡状态的标志是A.2υ(正、A2)= υ(逆、AB)B.容器内的总压强不随时间而变化C.单位时...
- 在一定条件下,对于密闭容器中进行的可逆反应:2SO3(g)。下列说法不正确的是A.改变反应条件可以改变该反应的限度B.达到平...
- (16分)硼酸(H3BO3)在食品、医药领域应用广泛。(1)请完成B2H6气体与水反应的化学方程式:B2H6+ 6H2O=2H3BO3+________。(2)...
- 某温度下,在一容积固定的容器中,反应aA(g)+bB(g)hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol。已知a+...
- 处于平衡状态的反应2 H2S(g)2H2(g)+S2(g)H>0,不改变其他条件的情况下合理的说法是A.加入催化剂,反应途径将发生改变,H也...
- 在体积为2L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)CH3OH(g).反应达到平衡时,平衡常数表达式K=_...
- T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应...
- α1和α2分别为A在甲、乙两个恒容容器中平衡体系A(g)2B(g)和2A(g)C(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列...
- 工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)⇌2NH3(g),△H=-92.44kJ/mol;其部分工艺流程如下:反应体系中各...