本试题 “(1)对可逆反应aA(g)+bB(g)cC(s)+dD(g)达到平衡时,其反应的K值与温度有关。请写出该反应的平衡常数表达式_____________现有反应:CO(g)+H2O(g)CO2(g)+H...” 主要考查您对化学平衡常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡常数
定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g) pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: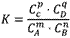
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
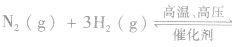


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: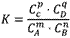
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
发现相似题
与“(1)对可逆反应aA(g)+bB(g)cC(s)+dD(g)达到平衡时,其反应...”考查相似的试题有:
- 在不同温度下,反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K如下表:(1)该反应的△H______0。(填“>”、“=”或“
- 在一密闭容器中进行可逆反应H2(g)+I2(g)?2 HI(g)并达到平衡,下列有关说法正确的是( )A.不论加多大压强,此化学平衡...
- (9分)(1)已知:NN的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程...
- 在密闭容器中进行如下反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,...
- 已知在等温等压条件下,化学反应方向的判据为:△H-T△S0 反应不能自发进行设反应A(s) C(g) +D(g) △H-T△S="(-4500+11T)" J/mol...
- 现有反应S2Cl2(l)+Cl2(g)2SCl2(l) ΔH=-50.16 kJ·mol-1(橙黄色) (鲜红色)在密闭容器中达到平衡,下列说法错误的是( )A....
- 1 mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)bZ(g)反应达到平衡后,测得X的转化率为50%。而且...
- (16分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。...
- 在恒容密闭容器中存在下列平衡:。 的平衡物质的量浓度与温度T的关系如右图所示。下列说法错误的是( ) A.反应的B.在时,...
- 将4 mol A气体和2 mol B气体在2 L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)2C(g) ΔH<0。4 s后反应达到平衡状...