本试题 “硫碘循环分解水制氢主要涉及下列反应:I SO2+2H2O+I2=H2SO4+2HIII 2HIH2+I2Ⅲ 2H2SO4=2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是____。a.反应Ⅲ易在常...” 主要考查您对影响化学平衡的因素
化学反应热的计算
化学反应速率的计算
化学平衡的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 影响化学平衡的因素
- 化学反应热的计算
- 化学反应速率的计算
- 化学平衡的有关计算
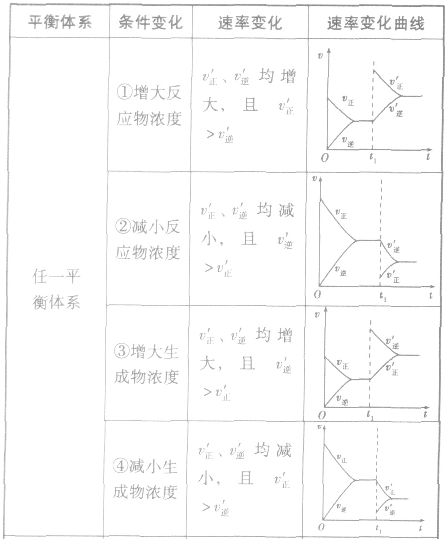
影响化学平衡的因素:
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
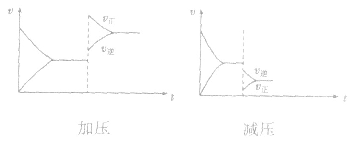
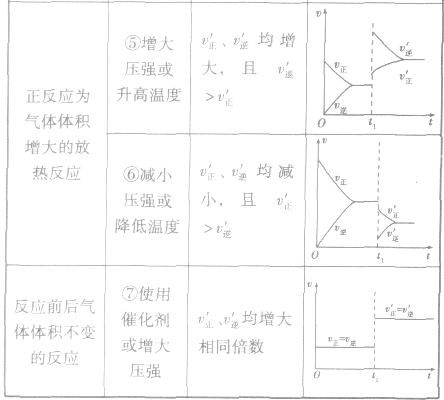
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应 来说,加压,
来说,加压,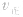 增大、
增大、 增大,
增大,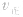 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,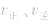 均减小,
均减小,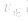 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
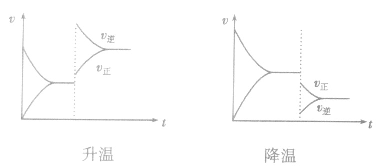
对于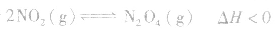 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
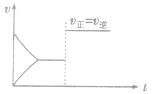
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为
稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
2.恒温恒压时
充入稀有气体 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。
3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了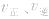 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
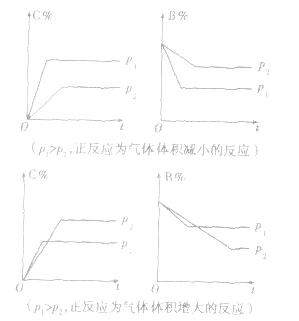
2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。

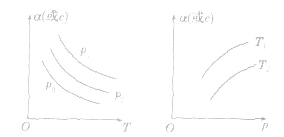
3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:
小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g) bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:

(2)若反应物不止一种时,如aA(g)+bB(g) cC(g)+dD(g):
cC(g)+dD(g):
a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如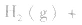
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,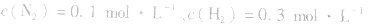 ,
,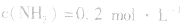 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让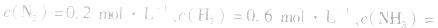
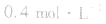 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如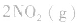
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物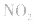 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
(1)浓度在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使化学平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使化学平衡向逆反应方向移动。
(2)压强对反应前后气体总体积发生变化的反应,在其他条件不变时,增大压强会使平衡向气体体积缩小的方向移动,减小压强会使平衡向气体体积增大的方向移动。对于反应
 来说,加压,
来说,加压,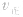 增大、
增大、 增大,
增大,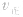 增大的倍数大,平衡向正反应方向移动:若减压,
增大的倍数大,平衡向正反应方向移动:若减压,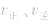 均减小,
均减小,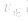 减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
减小的倍数大,平衡向逆反应方向移动,加压、减压后v一t关系图像如下图:
(3)温度在其他条件不变时,温度升高平衡向吸热反应的方向移动,温度降低平衡向放热反应的方向移动
对于
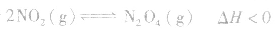 ,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
,加热时颜色变深,降温时颜色变浅。该反应升温、降温时,v—t天系图像如下图:
(4)催化剂由于催化剂能同等程度地改变正、逆反应速率,所以催化剂对化学平衡无影响,v一t图像为

稀有气体对化学反应速率和化学平衡的影响分析:
1.恒温恒容时
充入稀有气体
 体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。
体系总压强增大,但各反应成分分压不变,即各反应成分的浓度不变,化学反应速率不变,平衡不移动。 2.恒温恒压时
充入稀有气体
 容器容积增大
容器容积增大 各反应成分浓度降低
各反应成分浓度降低 反应速率减小,平衡向气体体积增大的方向移动。
反应速率减小,平衡向气体体积增大的方向移动。3.当充入与反应无关的其他气体时,分析方法与充入稀有气体相同。
化学平衡图像:
1.速率一时间因此类图像定性揭示了
 随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。

2.含量一时间一温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。


3.恒压(温)线该类图像的纵坐标为物质的平衡浓发(c)或反应物的转化率(α),横坐标为温度(T)或压强 (p),常见类型如下图:

小结:
1.图像分析应注意“三看”
(1)看两轴:认清两轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定二议一”的方式进行分析
平衡移动方向与反应物转化率的关系:
1.温度或压强改变引起平衡向正反应方向移动时,反应物的转化率必然增大。
2.反应物用量的改变
(1)若反应物只有一种时,如aA(g)
 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
(2)若反应物不止一种时,如aA(g)+bB(g)
 cC(g)+dD(g):
cC(g)+dD(g): a.若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
b.若按原比例同倍数的增加反应物A和B的量,则平衡向正反应方向移动,而反应物的转化率与气体物质的计量数有关:

c.若不同倍增加A、B的量,相当于增加了一种物质,同a。
3.催化剂不改变转化率。
4.反应物起始的物质的量之比等于化学计量数之比时,各反应物转化率相等。
浓度、压强影响化学平衡的几种特殊情况:
1.当反应混合物中存在固体或纯液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或纯液体的量,对平衡基本无影响。
2.南于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化对平衡无影响。
3.对于气体分子数无变化的反应,如
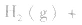
 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。 4.对于有气体参加的反应,同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响,如某平衡体系中,
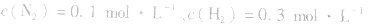 ,
,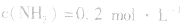 ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让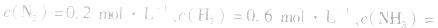
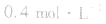 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 5.在恒容的密闭容器中,当改变其中一种气体物质的浓度时,必然同时引起压强改变,但判断平衡移动的方向时,心仍从浓度的影响去考虑:如
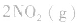
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物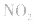 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小应用盖斯定律进行计算的方法:
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
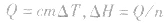
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
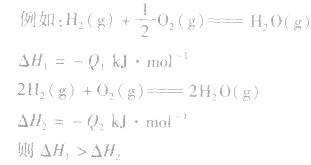
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即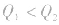 .
.
用盖斯定律结合已知反应的反应热求解一些相关反应的反应热时,其关键是设计出合理的反应过程,将已知热化学方程式进行适当数学运算得未知反应的方程式及反应热,使用盖斯定律时应注意以下问题:
(1)当反应方程式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应方程式进行加减运算时,△H也同样要进行加减运算,且要带“+”“-”符号,即把△H看做一个整体进行运算
(3)通过盖斯定律计算并比较反应热的大小时,同样要把△H看做一个整体
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互互转化,状态由固→液→气变化时。会吸热;反之会放热
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
反应焓变(反应热)的简单计算:
1.根据热化学方程式计算焓变与参加反应的各物质的物质的量成正比。
2.根据反应物和生成物的能量计算
△H生成物的能量总和一反应物的能量总和。
3.根据反应物和生成物的键能计算
△H反应物的总键能-生成物的总踺能。
4.根据盖斯定律计算
将两个或两个以上的热化学方程式进行适当的数学运算,以求得所求反应的反应热。
5.根据比热公式进行计算
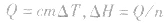
6.反应焓变的大小比较在比较两个热化学方程式中,△H的大小时要带 “+”“-”,比较反应放出或吸收的热量多少时要去掉 “+”“-” .
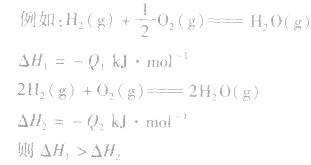
1molH2完全燃烧生成气态水时放出的热量Q1小于2molH完全燃烧生成气态水时放出的热量Q2,即
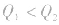 .
.化学反应速率的求算:
首先要熟练掌握化学反应速率的含义,明确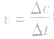 中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为
中各个量的含义和单位,如:以具体某一种物质 B表示的化学反应速率为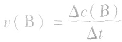 。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是
。△c的单位一般用mol/L表示,而△t的单位一般用s(秒)、min (分钟)、h(小时)等表示,所以v的单位可以是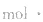

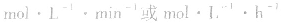 等。对于反应
等。对于反应 ,有
,有 ,利用这一关系,可以很方便地求算出不同物质表示的v的数值:
,利用这一关系,可以很方便地求算出不同物质表示的v的数值:
化学反应速率图像及其应用:
1.物质的量(或浓度)一时间图像及应用此类图像能说明反应体系各组分(或某一组分)在反应过程中的浓度变化情况。如A(g) +B(g)
 3C(g)的反应情况如图所示,
3C(g)的反应情况如图所示,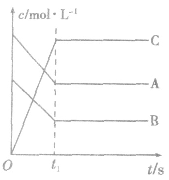
要注意此类图像各曲线的折点(达平衡)时刻相同,各物质浓度变化符合化学方程式中的计量数关系。例如:某温度时,在恒容(VL)容器中,X、Y、z三种物质的物质的量随时间的变化曲线如下图所示。
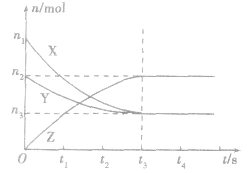
根据图像可进行如下计算:
(1)计算某物质在O一t3刻的平均反应速率、转化率,如
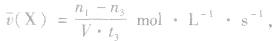 Y的转化率为
Y的转化率为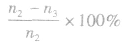 .
.(2)确定化学方程式中各物质的化学计量数之比如X、Y、z三种物质的化学计量数之比为: (n1一n3):(n2一n3):n2。
2.全程速率一时间图像如Zn与足量盐酸的反应,反应速率随时间的变化出现的情况,如图所示,

解释原因:AB段(v增大),因反应为放热反应,随反应的进行,温度升高,导致反应速率增大;BC段(v减小),则主要因为随反应的进行,溶液中 c(H+)减小,导致反应速率减小。故分析时要抓住各阶段的主要矛盾,认真分析。
3.速率一温度(压强)图像这类图像有两种情况:一是不隐含时间变化的速率一温度(压强)图,二是隐含时间变化的速率一温度 (压强)图。以
 ,△H< 0为例,V一T(P)图像如下:
,△H< 0为例,V一T(P)图像如下: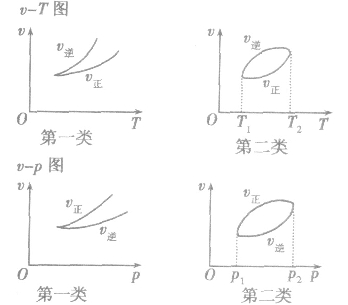
化学平衡计算的一般思路和方法:
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g) pC(g)+ qD(g)
pC(g)+ qD(g)
(1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
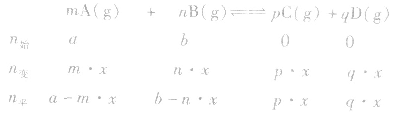
则有:

(2)对于反应物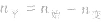 ,对于生成物
,对于生成物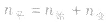
(3)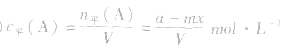
(4)A的转化率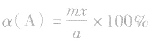
(5)平衡时A的体积(物质的量)分数
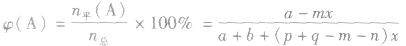
(6)
(7)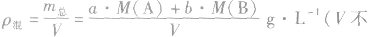
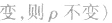
(8)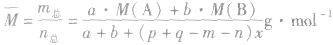
有天化学平衡的计算一般涉及各组分的物质的量、浓度、转化率、百分含量,气体混合物的密度、平均摩尔质量、压强等。通常的思路是写出反应方程式,列出相关量(起始量、变化量、平衡量),确定各量之间的火系,列出比例式或等式或依据平衡常数求解,这种思路和方法通常称为“三段式法”、如恒温恒压下的反应mA(g)+nB(g)
 pC(g)+ qD(g)
pC(g)+ qD(g) (1)令A、B的起始物质的量分别为amol,bmol 达到平衡后,A的消耗量为m·xmol,容器容积为VL。
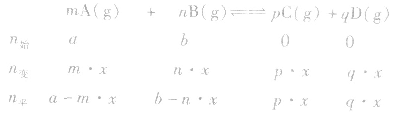
则有:

(2)对于反应物
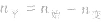 ,对于生成物
,对于生成物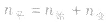
(3)
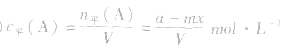
(4)A的转化率
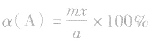
(5)平衡时A的体积(物质的量)分数
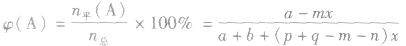
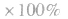
(6)

(7)
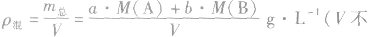
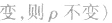
(8)
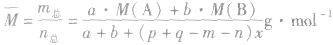
发现相似题
与“硫碘循环分解水制氢主要涉及下列反应:I SO2+2H2O+I2=H2SO4+2...”考查相似的试题有:
- 在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同温度下任其发生反应:A2(g)+2B2(g)2AB2(g),分别在某时刻测得其中AB...
- 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) 下列叙述错误的是[ ]A.反...
- 已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.0kJ·mol-12NO(g)+O2(g)2NO2(g) ΔH="-113.0" kJ·mol-12SO3(l)2SO3(g) ΔH...
- 氨在工农业生产中应用广泛。在压强为30 MPa 时,合成氨平衡混合气体中NH3的体积分数如下请回答:(1)根据表中数据,结合化学平...
- 在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该...
- 在500℃、101KPa条件下,将amol SO2与bmol O2充入一容积可变的密闭容器中,达到平衡时SO3体积分数为40%,若温度和压强保持不变...
- 把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(气)+B(气) 2C(气)+。XD(气)经5min达到平衡...
- 用来表示可逆反应:2A(g)+B(g)2C(g)ΔH<0的正确图象是下图中的( )A B C D
- 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在...
- 0.096mol的CO和0.075mol的O2在100mL的密闭容器中混合,加热到某一温度发生反应并达到平衡时,有0.08mol的CO2生成.①计算该温...