本试题 “下列叙述不正确的是[ ]A.铁表面镀锌,铁作阳极B.船底镶嵌锌块,锌作负极,以防船体被腐蚀C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-D.工业上电解饱和食...” 主要考查您对电解饱和氯化钠溶液
电镀
金属的电化学腐蚀
金属的电化学防护
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 电解饱和氯化钠溶液
- 电镀
- 金属的电化学腐蚀
- 金属的电化学防护
在小烧杯(或U型管)里装入饱和食盐水,滴入几滴酚酞试液。用导线把碳棒、电池、电流表和铁钉相连(如图)。接通直流电源后,注意观察电流表的指针是否偏转,以及小烧杯内发生的现象,并用湿润的碘化钾淀粉试纸检验阳极放出的气体。
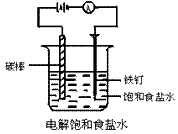
注:粗铁钉要与直流电源的阴极相连,碳棒与阳极相连。
用玻璃棒沾湿润的KI淀粉试纸检验阳极气体。
(1)饱和食盐水电解时,电流表指针发生偏转,阴、阳极均有气体放出,阳极气体有刺激性气味,并能使湿润的KI淀粉试纸变蓝,且阴极区溶液变红。
(2) 阳极:2Cl--2e-==Cl2↑
阴极:2H++2e-==H2↑(或2H2O+2e-==2OH-+H2↑)
总反应式:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑ (3)阴极区溶液变红的原因:这是由于饱和食盐水中,水所电离出的H+在阴极放电,破坏了水的电离平衡
(H2O
 H++OH-)致使阴极区附近溶液中的OH-相对较多,溶液呈碱性,故酚酞变红。
H++OH-)致使阴极区附近溶液中的OH-相对较多,溶液呈碱性,故酚酞变红。 (4)例用电解饱和食盐水溶液可制取氢气、氯气和烧碱。
电镀:
(1)概念:应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。
(2)目的:使金属增强抗腐蚀能力,增加美观和表面硬度。镀件(待镀金属制品)作阴极
(3)要求
如在铁制品表面上镀铜: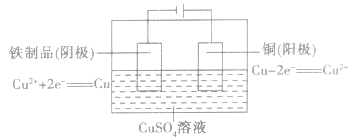
注意:理论上,电镀过程中电镀液的浓度保持不变。
金属的腐蚀:
1.金属腐蚀的概念金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.金属腐蚀的实质金属原子(M)失去电子而被氧化的过程。
M-ne-==M n+
金属的电化学腐蚀:
不纯的金属或合金因发生原电池反应而造成的腐蚀。最普遍的钢铁腐蚀是:
负极:2Fe-4e-=2Fe2+
正极:O2+2H2O+4e-=4OH- (注:在少数情况下,若周围介质的酸性较强,正极的反应是:2H++2e-=H2↑)
金属的腐蚀以电化腐蚀为主.例如,钢铁生锈的主要过程为
(1)吸氧腐蚀:金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化腐蚀。
①发生条件:水膜的酸性很弱或呈中性
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
(2)析氢腐蚀:在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀。
①发生条件:水膜的酸性较强
②反应本质:形成原电池
③铁为负极,(氧化反应);正极反应:(还原反应)
钢铁的电化学腐蚀的两种类型:


金属腐蚀快慢的判断:
金属腐蚀的快慢与下列两个因素有关:
(1)与构成原电池的材料有关,两极材料的活泼性差别越大,电动势越大,氧化还原反应的速率越快,活泼金属被腐蚀的速率就越快。
(2)与金属所接触的电解质溶液的性质有关,活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。一般来说,可用下列原则判断:电解原理引起的腐蚀>原电池原理引起的腐蚀> 化学腐蚀>有防护措施的腐蚀
(1)外加电流的阴极保护法。如把金属连接在电源的负极上,这样就能消除引起金属腐蚀的原电池反应。
(2)牺牲阳极的阴极保护法。如在金属上铆接比它更活泼的另一种金属,发生金属腐蚀时是较活泼的金属被腐蚀而金属本身受到保护。
与“下列叙述不正确的是[ ]A.铁表面镀锌,铁作阳极B.船底镶嵌锌...”考查相似的试题有:
- 关于下列四个图像的说法中正确的是[ ]A.图④表示可逆反应“CO(g)+H2O(g)CO2(g)+H2(g)” 中的△H大于0B.图②是以石墨为电极电解氯化...
- (10分)如图所示,常温,U形管内盛有100mL的溶液,请按要求回答下列问题。(1)若所盛溶液为CuSO4溶液,打开K2,闭合K1,则:...
- 有关下列电化学装置的说法中正确的是A.图a是原电池装置,可以实现化学能转化为电能B.图b电解一段时间后,加入适量CuCO3固体...
- 科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2Li2O2...
- 如图所示烧杯中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )A.(4)(3)(2)(1)B.(4)(3)(1)(2)C.(3)...
- (1)将铜棒与锌棒用导线连接,分别插入盛有:①硫酸溶液;②硫酸铜溶液;③硫酸钠溶液的三个烧杯中,此时,铜棒上发生的主要反应...
- D、E为中学化学常见的金属单质,F是一种黑色晶体。E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成...
- 如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )A.②①③④⑤⑥B.⑤④③①②⑥C.⑤④②①③⑥D.⑤③②④①⑥
- 下列各种镀有金属保护层的铁板,当镀层破损时相同的普通环境中,最易被腐蚀的是( )A.镀锌铁(白铁)B.镀锡铁(马口铁)C...
- 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )A.a管发生吸氧腐蚀,b管...