本试题 “CuSO4溶液是中学化学及工农业生产中常见的一种试剂。(1)某同学配置CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊...” 主要考查您对沉淀溶解平衡
原电池原理
金属、非金属的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 沉淀溶解平衡
- 原电池原理
- 金属、非金属的有关计算
1、定义:在一定条件下,当难容电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。
例如:
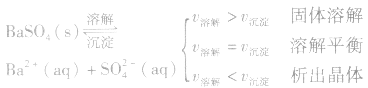
2、沉淀溶解平衡的特征:
(1)逆:沉淀溶解平衡是可逆过程。
(2)等:
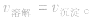
(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)定:达到平衡时,溶液中各离子的浓度保持不变,
(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3、沉淀溶解平衡的影响因素
(1)内因:难溶电解质本身的性质。
(2)外因
a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但
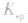 不变。
不变。 b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时
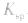 变大。
变大。 c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但
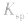 不变。
不变。 d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,
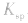 不变。
不变。沉淀溶解平衡的应用:
1.沉淀的生成
(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法
a.调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使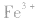 转变为
转变为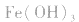 沉淀而除去。
沉淀而除去。 
b.加沉淀剂法:如以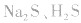 等作沉淀剂,使某些金属离子如
等作沉淀剂,使某些金属离子如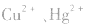 等生成极难溶的硫化物
等生成极难溶的硫化物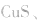
 等沉淀,也是分离、除杂常用的方法。
等沉淀,也是分离、除杂常用的方法。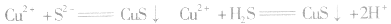
说明:化学上通常认为残留在溶液中的离子浓度小于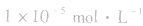 时即沉淀完全。
时即沉淀完全。
2.沉淀的溶解
(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使 平衡就会向沉淀溶解的方向移动,使沉淀溶解。
平衡就会向沉淀溶解的方向移动,使沉淀溶解。
(2)方法
a.生成弱电解质:加入适当的物质,使其与沉淀溶解平衡体系中的某离子反应生成弱电解质。如向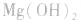 沉淀中加入
沉淀中加入 溶液,
溶液,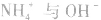 结合生成
结合生成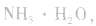 使
使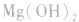 的溶解平衡向右移动。
的溶解平衡向右移动。
b.生成配合物:加入适当的物质,使其与沉淀反应生成配合物。
如:

c.氧化还原法:加入适当的物质,使其与沉淀发生氧化还原反应而使沉淀溶解。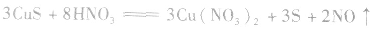
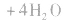
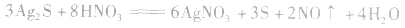
d.沉淀转化溶解法:本法是将难溶物转化为能用上述三种方法之一溶解的沉淀,然后再溶解:
如向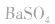 中加入饱和
中加入饱和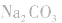 溶液使
溶液使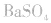 转化为
转化为 再将
再将 溶于盐酸。
溶于盐酸。
3.沉淀的转化
(1)实质:沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现。 例如
(2)沉淀转化在工业上的应用在工业废水处理的过程中,用FeS等难溶物作沉淀剂除去废水中的重金属离子.
固体物质的溶解度:
绝对不溶解的物质是不存在的,任何难溶物质的溶解度都不为零。不同的固体物质在水中的溶解度差别很大,可将物质进行如下分类: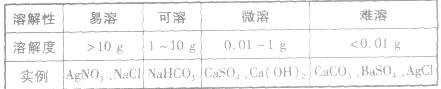
1.定义:将化学能转化为电能的装置。
2.工作原理:
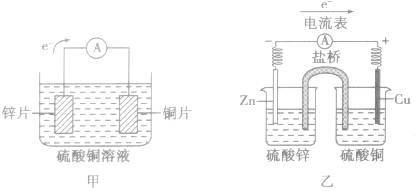
以铜-锌原电池为例

(1)装置图:
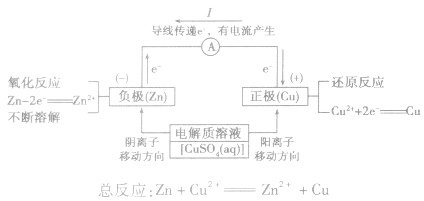
(2)原理图:
3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
包括金属及化合物、金属与非金属化合物、非金属化合物之间的反应的计算,解此类题的关键是正确的写出反应方程式,明确物质间的等量关系。明确物质之间的反应,正确写出方程式,此类题可迎刃而解。
AlCl3与NaOH反应的相关计算:
1、求Al(OH)3沉淀的量
2、求反应物碱的量
铝与酸、碱反应的计算规律:
铝分别与盐酸、氢氧化钠溶液反应的原理: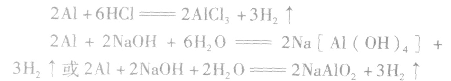
(1)等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气的体积比为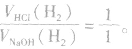
(2)足量的锅分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为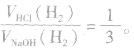
(3)一定量的铝分别和一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为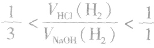 ,则必定是:
,则必定是:
①铝与盐酸反应时,铝过量而盐酸不足;
②铝与氢氧化钠溶液反应时,铝不足而氢氧化钠过量。
解有关硝酸与金属反应的计算题的技巧:
1.灵活运用得失电子守恒、原子守恒及溶液中的电荷守恒关系例如Cu与HNO3反应中就有以下等量关系:
(1)N原子守恒:反应前所有的N只存在于HNO3中;反应后含N的物质有HNO3的还原产物(假设此处有NO3、NO)和Cu(NO3)3,若HNO3过量,则过量HNO3中也含一部分N,则有:n(N)=n(NO2)+ n(NO)+2n[Cu(NO3)3]+n剩(HNO3)。
(2)得失电子守恒:在反应中失去电子的是参加反应的Cu, ;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有:
;得到电子的是被还原的HNO3(假设还原产物为NO2、NO),NO3-+e→ NO2、NO3-+3e→NO。根据得失电子守恒,则有: 
(3)溶液中的电荷守恒:在任何溶液中,阴离子所带负电荷总数与阳离子所带正电荷总数在数值上是相等的。在Cu与HNO3反应后的溶液中,若HNO3不过量,阳离子只有Cu2+,阴离子只有NO3-(此类计算不考虑H2O电离出的极少量的H+、OH-);若HNO3过量,溶液中阳离子有Cu2+和H+,阴离子只有NO3-。则有:
①若HNO3不过量: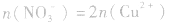
②若HNO3过量: 
2.铁与稀HNO3的反应规律 

(2)上述反应可以认为先发生反应①,若Fe有剩余则发生 ①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的
①×2+ ③即得反应②,所以,无论是反应①还是反应②,被还原的HNO3皆占参加反应的HNO3的 。
。
有关镁、铝的图像集锦:
Al(OH)3与Al3+、AlO2-之间的转化,是建立在 Al(OH)3两性基础上的,有关相互转化的配比和沉淀Al(OH)3的质量变化,见下表:
与“CuSO4溶液是中学化学及工农业生产中常见的一种试剂。(1)某同...”考查相似的试题有:
- 100mL 0.1mol/L的盐酸与50mL 0.2mol/L的氨水混合,充分反应后,所得溶液中各种离子浓度关系正确的是( )A.c(Cl-)>c(NH4...
- 一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)Ca2+(aq)+2OH(aq),当向一定量的石灰乳悬浊液中加入少量生石灰...
- 下列叙述正确的是( )A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(...
- 人们应用原电池原理制作了多种电池,以满足不同的需要。在现代生活、生产和科学技术的发展中,电池发挥着越来越重要的作用。...
- 下列有关工业生产的叙述中,不正确的是高温( )A.硫酸工业中,在接触室安装热交换器是为了循环利用反应放出的热量B.工业上...
- (14分)铅蓄电池是可充电型电池,它的正负极极板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2PbSO4+2H2O请回答下列问题(...
- (6分)若定义某物质的转化率为消耗掉的该物质的物质的量占起始时该物质的原物质的量的百分比。已知合成氨反应为N2(g) + 3H2(...
- Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。(1)该电池的负极材料是________。电池工作时,电子流向______...
- 如图所示的原电池中,正极发生的反应及电极反应式是( )A.还原反应; Cu2++2e-=CuB.氧化反应; Cu-2e-=Cu2+C.还原反应; ...
- 现有A、B、C、D四种金属片,①把A 、B 用导线连接后同时浸入稀硫酸中,A 上有气泡;②把C 、D 用导线连接后同时浸入稀硫酸中,D...