本试题 “目前世界上60%的镁是从海水中提取的,某校学生设计从海水中提取镁的实验流程如下图。请思考并回答I.上述实验过程中涉及的①、②、③反应属于氧化还原反应的是__...” 主要考查您对海水资源的综合利用
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 海水资源的综合利用
海水资源的综合利用:
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
浩瀚的海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还孕育着丰富的矿产,而海水本身含有大量的化学物质,又是宝贵的化学资源。可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质,海水素有“液体工业原料”之美誉。
海水制盐:
(1)海水制盐的方法:从海水中得到食盐的方法有蒸发法(盐田法)、电渗析法等。目前,以蒸发法(盐田法)为主。
(2)海水晒盐的基本原理:水分不断蒸发,氯化钠等盐结晶析出。
(3)海水晒盐的流程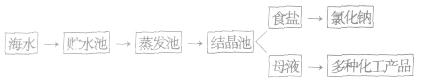
氯碱工业:
(1)食盐水的精制
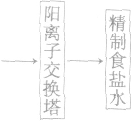
(2)电极反应
阴极: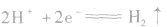
阳极:
总反应: :
:
(3)主要设备
离子交换膜电解槽一一阳极用金属钛(表面涂有钛、钉氧化物层)制成,阴极用碳钢(覆有镍镀层)制成。阳离子膜具有选择透过性,只允许Na+透过,而Cl-、 OH一和气体不能透过。 
(4)产品及用途
烧碱:可用于造纸、玻璃、肥皂等工业
氯气:可用于制农药、有机合成、氯化物的合成
氢气:可用于金属冶炼、有机合成、盐酸的制取
海水提溴:
(1)氯化
氯化氧化溴离子,在pH=3.5的酸性条件下效果最好,所以在氯化之前要将海水酸化。
(2)吹出
当海水中的Br一被氧化成Br2以后,用空气将其吹出。另外,也可以用水蒸气,使溴和水蒸气一起蒸出。
(3)吸收
目前比较多的是用二氧化硫作还原剂,使溴单质转化为HBr,再用氯气将其氧化得到溴产品。化学方程式如下: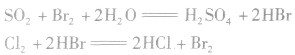
海水提镁:
(1)工艺流程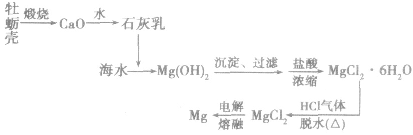
(2)主要化学反应
①制备石灰乳: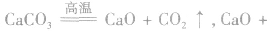
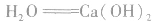
②沉淀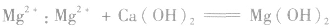
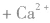
③制备
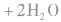
从海水中提取重水:
提取重水的方法:蒸馏法、电解法、化学交换法、吸附法等。常用方法:化学交换法(硫化氢一水双温交换法)
铀和重水目前是核能开发中的重要原料,从海水中提取铀和重水对一个国家来说具有战略意义,化学在开发海洋药物方面也将发挥越来越大的作用。潮汐能、波浪能也是越来越受到重视的新型能源。
发现相似题
与“目前世界上60%的镁是从海水中提取的,某校学生设计从海水中提...”考查相似的试题有:
- )【化学—选修化学与技术】工业上以磷肥生产形成的副产物石膏(CaSO4·2H2O)与焦炭为原料可生产硫酸,同时可以得到硫酸钾肥料和...
- 面粉加工厂的车间里若悬浮着较多的面粉粉尘,遇明火就有发生爆炸的危险。下面是模拟粉尘爆炸的一个实验。如下图,在小塑料筒...
- (10分)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池...
- 从化学原理和经济效益角度分析下列从海水中提取镁单质的方法最可行的是( ) A.海水Mg(OH)2Mg B.海水MgCl2Mg C.海水Mg(...
- 下列海水淡化的方法不正确的是( )A.蒸馏法B.电渗析法C.萃取法D.离子交换法
- 海水中含有丰富的化学元素,如图是某化工厂利用海水的生产镁的流程简图,请回答:(1)实验室中蒸发浓缩液体需要的仪器有玻璃...
- (1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.①电解一段时间后,B中出现浑浊现象,请用离子方程式表示原因_...
- 下列有关海水资源综合利用的说法正确的是①蒸馏法是海水淡化的方法之一②海水蒸发制海盐的过程中只发生化学变化③从海带提取碘单...
- 海水中溶解了大量的气体物质和各种盐类.人类在陆地上发现的100多种元素,在海水中可以找到80多种.海洋是一个远未完全开发的...
- (4分)氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水同时得到两种气体(气体A是所有气体中密度最小的气体,气体B...