本试题 “为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水试样10.00mL加水稀释至100mL,加入10.0mL一定浓度的KBrO3和KBr的混合溶液,立即加入5mL盐酸,摇匀...” 主要考查您对苯酚
有机反应方程式
有机化学的有关计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 苯酚
- 有机反应方程式
- 有机化学的有关计算
苯酚的结构:
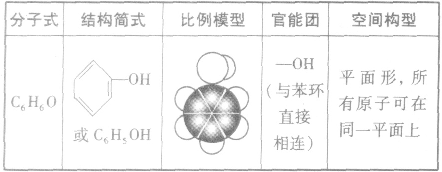
苯酚的性质:
1.物理性质纯净的苯酚是无色的晶体,露置在空气里会因被氧化而呈粉红色。苯酚具有特殊的气味,熔点为43℃。室温时,在水中的溶解度不大,当温度高于65℃时,则能与水以任意比互溶。苯酚易溶于乙醇、乙醚等有机溶剂,有毒,它的浓溶液对皮肤有强烈的腐蚀性。
2.苯酚的化学性质
苯酚的分子结构中既有苯环,又有羟基,它们相互影响。苯酚具有酸性,能与溴水、浓硝酸等发生取代反应,也能与氢气发生加成反应,苯酚还能与FeCl3溶液发生显色反应(显紫色)。
(1)苯酚的弱酸性
实验步骤:取苯酚浊液加氢氧化钠溶液,会变澄清。将得到的澄清液放人两支试管中,分别加入盐酸和通入二氧化碳气体。
实验现象:澄清液加入盐酸和通入二氧化碳气体后又会变浑浊。
实验结论:苯环对羟基的影响结果是使羟基的活性增强,在水溶液中能电离出H+。
反应方程式: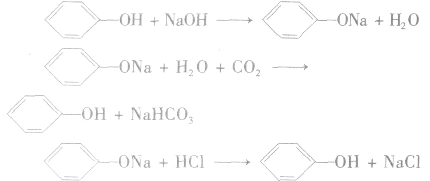
注意:苯酚具有酸性,但是苯酚的酸性极弱,它不能使酸碱指示剂显色,它与碳酸的电离程度的大小为: 因此,苯酚在与碳酸钠溶液反应时,只能生成碳酸氢钠和苯酚钠,而不能生成水和CO2。
因此,苯酚在与碳酸钠溶液反应时,只能生成碳酸氢钠和苯酚钠,而不能生成水和CO2。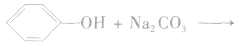
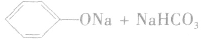
由于苯酚的酸性很弱,因此苯酚钠在水溶液中水解而使溶液显碱性:
相同浓度时,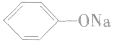 溶液的碱性比
溶液的碱性比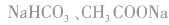 溶液的碱性强。
溶液的碱性强。
(2)苯环上的取代反应
①卤代反应
实验步骤:向少量稀苯酚中加入饱和溴水,观察实验现象。
实验现象:有白色沉淀生成。
实验结论:由于羟基对苯环的影响,使苯环上与羟基处在邻位和对位上的氢原子活性增强,容易被取代。
反应方程式: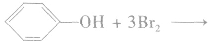
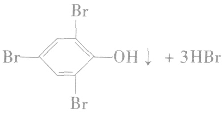
苯酚与溴的反应很灵敏,可用于苯酚的定性检验和定量测定。
注意:2,4,6一三溴苯酚不溶于水,但易溶于苯,若苯中溶有少量苯酚,加浓溴水不会产生白色沉淀,因而用溴水检验不出溶于苯中的苯酚,也不能用溴水来除去苯中混有的少量苯酚(应加NaOH溶液后分液)。
②硝化反应
苯需用混酸进行硝化,而苯酚很容易硝化,与浓硝酸反应即可生成三硝基苯酚。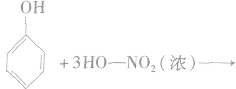
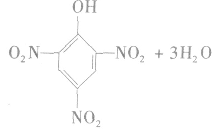
反应生成的2,4,6一三硝基苯酚,俗称苦味酸,可以用作炸药。
(3)苯酚的显色反应苯酚跟FeCl3溶液作用显示紫色,利用这一反应可以检验苯酚的存在。 
(4)氧化反应苯酚晶体在常温下易被空气中的氧气氧化,它也易燃烧,易被酸性KMnO4溶液氧化。
(5)加成反应
苯酚可在苯环上发生加成反应。如:

(6)苯酚与甲醛的缩聚反应
苯酚和甲醛在酸或碱的催化作用下发生反应生成酚醛树脂,反应方程式为: 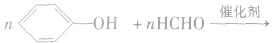
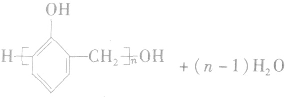
4.苯酚的主要用途
苯酚是一种重要的化工原料,广泛用于制造酚醛树脂、染料、医药、农药等。炼焦工业的废水中常含有酚类物质,这些物质是被控制的水污染物之一,在排放前必须经过处理。
苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂。
(1)有机反应方程式中有机物写结构简式。
在书写有机物结构简式时,注意:碳只能形成四个共价键,不能少写或多写氢。
例新戊烷(CH3)4C,不能写成(CH2)4C或(CH3)4CH2。
(2)一些基团的连接方式要即正确又合乎习惯,不产生歧义。
例醛基-CHO,不能写成CHO-也不能写成-COH(写成此种形式,可能会误认为碳原子和氧原子之间是单键)。另外常见官能团-C6H5、-OH、-NO、-NH2、-COOH等不能写成C6H5-、OH-、NO2-、NH2-、COOH-等,尤其注意官能团写在物质左侧的。
(3)注意有机反应的条件,反应物和产物中间用“→”连接。
有机反应方程式举例:
一、烷烃、烯烃、炔烃
1. 甲烷的实验室制法C2H5OH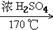 CH2=CH2↑+H2O
CH2=CH2↑+H2O
2. 甲烷燃烧CH4+2O2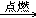 CO2+2H2O
CO2+2H2O
3. 甲烷与氯气CH4+Cl2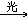 CH3Cl+HCl
CH3Cl+HCl
CH3Cl+Cl2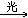 CH2Cl2+HCl
CH2Cl2+HCl
CH2Cl2+Cl2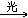 CHCl3+HCl
CHCl3+HCl
CHCl3+Cl2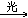 CCl4+HCl
CCl4+HCl
4. 甲烷隔绝空气时高温分解CH4 C+2H2
C+2H2
5. 丁烷的裂解(两个方程式)C4H10 CH4+C3H6
CH4+C3H6
C4H10 C2H4+C2H6
C2H4+C2H6
6. 乙烯的实验室制法CH3CH2OH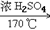 CH2=CH2↑+H2O
CH2=CH2↑+H2O
7. 乙烯燃烧C2H4+3O2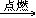 2CO2+2H2O
2CO2+2H2O
8. 乙烯使溴水褪色CH2=CH2+Br2→CH2Br─CH2Br
9. 乙烯与水在催化剂下反应CH2=CH2+H2O C2H5OH
C2H5OH
12. 乙烯的加聚
13. 乙烯与丙烯1:1加聚
14. 异戊二烯聚合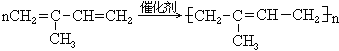
15. 苯乙烯与异戊二烯1:1加聚
16. 乙炔的实验室制法CaC2+2H2O→CH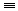 CH↑+Ca(OH)2
CH↑+Ca(OH)2
17. 乙炔与足量氢气反应CH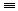 CH+2H2
CH+2H2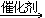 CH3-CH3
CH3-CH3
18. 乙炔的聚合
19. 由乙炔制备聚氯乙烯CH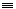 CH+HCl
CH+HCl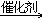 CH2=CHCl
CH2=CHCl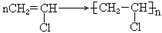
二、苯及其同系物
20. 苯燃烧2C6H6+15O2 12CO2+6H2O
12CO2+6H2O
21. 苯与液溴反应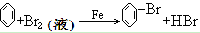
22. 甲苯的硝化反应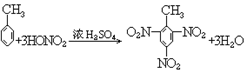
23. 苯与氢气反应
25. 甲苯与浓硝酸、浓硫酸反应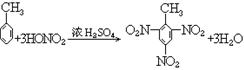
三、卤代烃的性质
26. 溴乙烷的消去反应CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
27. 溴乙烷的水解反应CH3-CH2-Br+NaOH CH3-CH2-OH+NaBr
CH3-CH2-OH+NaBr
28. 氯苯与氢氧化钠水溶液反应
四、醇的性质
29. 乙醇燃烧C2H5OH+3O2 2CO2+3H2O
2CO2+3H2O
30. 乙醇与钠反应2C2H5OH+2Na→2C2H5ONa+H2↑
31. 乙醇的催化氧化2C2H5OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
32. 乙醇与浓硫酸反应(两个方程式)CH3CH2OH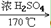 CH2=CH2↑+H2O
CH2=CH2↑+H2O
2CH3CH2OH CH3─CH2─O─CH2─CH3+H2O
CH3─CH2─O─CH2─CH3+H2O
33. 乙醇与乙酸反应C2H5OH+CH3COOH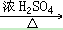 CH3COOC2H5+H2O
CH3COOC2H5+H2O
34. 乙二醇与钠反应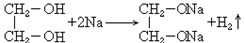
35. 甘油与硝酸反应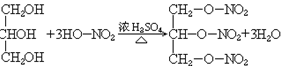
五、酚的性质
36. 苯酚与钠反应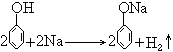
37. 苯酚与氢氧化钠反应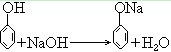
38. 苯酚与浓溴水反应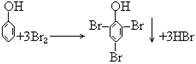
39. 苯酚钠与二氧化碳反应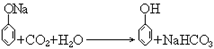
40. 苯酚与甲醛缩聚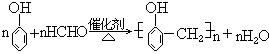
包括确定有机物分子中元素质量比,所含原子个数,有机物燃气确定其组成,确定有机物分子中元素质量分数,确定有机物分子式、结构简式等。确定有机物分子式、结构简式的计算: (1)先求有机物的最简式和相对分子质量,再依(最简式相对分子质量)n=相对分子质量,求得分子式,再根据题中给的信息确定有机物的官能团,进而确定有机物的结构简式。
(2)商余法适用于烃分子式的确定:商为C原子数,余数为H原子数。注意:一个C原子的质量=12个H原子的质量
有机物分子式的确定:
1.有机物组成元素的判断一般来说,有机物完全燃烧后各元素对应的产物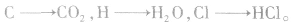 若某有机物完全燃烧后产物只有
若某有机物完全燃烧后产物只有 则其组成元素可能为 C、H或C、H、O。欲判断该有机物是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将C、H的质量之和与原来有机物的质量比较,若二者相等,则原有机物中不含氧元素;若有机物的质量大于C、H的质量之和,则原有机物中含氧元素。
则其组成元素可能为 C、H或C、H、O。欲判断该有机物是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将C、H的质量之和与原来有机物的质量比较,若二者相等,则原有机物中不含氧元素;若有机物的质量大于C、H的质量之和,则原有机物中含氧元素。
2.确定有机物分子式的方法
(1)实验式法:实验式又叫最简式。
(2)物质的量关系法:由密度或其他条件 求摩尔质量
求摩尔质量 求1moL分子中所含元素原子的物质的量
求1moL分子中所含元素原子的物质的量 求分子式。
求分子式。
(3)化学方程式法(代数法):利用化学方程式 列方程组
列方程组 求解未知数值
求解未知数值 求分子式。
求分子式。
(4)通式法:题干要求或物质性质 类别及组成通式
类别及组成通式 n值
n值 分子式。
分子式。
3.相对分子质量的测定方法
相对分子质量的测定方法——质谱法,找最大质荷比,确定相对分子质量。
4.有机物的相对分子质量的相关规律
(1)设烃的混合物的平均相对分子质量为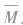 ,平均分子式为
,平均分子式为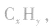 则:
则:
①若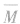 <26,则一定有CH4;
<26,则一定有CH4;
②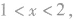 则一定有CH4;
则一定有CH4;
③若y<4,则一定有C2H2。
(2)最简式相同规律
①含有n个碳原子的饱和一元醛与含有2n个碳原子的饱和一元羧酸和饱和一元酯具有相同的最简式 (n≥2)。
②含有n个碳原子的炔烃与含有3n个碳原子的苯及其同系物具有相同的最简式。最简式相同的有机物,无论多少种,以何种比例混合,混合物中元素质量比例相同。
(3)相对分子质量相同规律
①同分异构体的相对分子质量必然相同。
②含有n个碳原子的一元醇与含(n—1)个碳原子的同类型一元羧酸和一元酯的相对分子质量相同。
③含有n个碳原子的烷烃与(n—1)个碳原子的饱和一元醛,即 的相对分子质量相同。
的相对分子质量相同。
④常见的相对分子质量相同的有机物和无机物有:
a.相对分子质量为28的有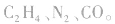
b.相对分子质量为30的有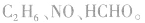
c.相对分子质量为44的有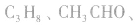

d.相对分子质量为46的有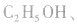
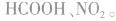
e.相对分子质量为60的有
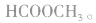
(4)由相对分子质量求烃的分子式
设烃的相对分子质量为M,由 可知:
可知:
若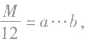 则烃的分子式为
则烃的分子式为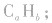 若b为0,则烃的分子式为
若b为0,则烃的分子式为 若b太小而不合理,则可变换为
若b太小而不合理,则可变换为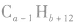 (减碳增氢法,减1个C原子,增加12个H原子)。如
(减碳增氢法,减1个C原子,增加12个H原子)。如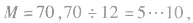 分子式为
分子式为 又如
又如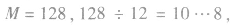 分子式为
分子式为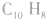 (萘)或
(萘)或 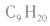 (壬烷)。
(壬烷)。
酚类化合物与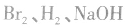 反应时最大用量的计算:
反应时最大用量的计算:
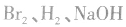 溶液是有机反应中的常见试剂,它们能参与的反应有哪些呢?
溶液是有机反应中的常见试剂,它们能参与的反应有哪些呢?
1.Br2:①与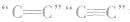 等发生加成反应;
等发生加成反应;
②取代酚羟基邻位、对位上的氢原子;
③取代饱和碳原子上的氢原子。
2.H2:与有机物中的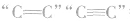 ,
,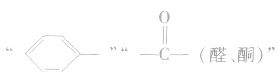 等发生加成反应。
等发生加成反应。
3.NaOH溶液:与酚、羧酸发生中和反应(但不与醇反应),催化卤代烃、酯等的水解并与水解生成的氢卤酸、酚、羧酸等发生中和反应。
注意:
①发生加成反应时,断裂双键或三键中的1mol键消耗1molBr2或H2;发生取代反应时,1molBr2只取代1mol(而不是2mol)氢原子(同时生成1molHBr)。
②H2不与羧酸、酯基及羧酸酐中的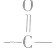 发生加成反应.
发生加成反应.
与“为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水...”考查相似的试题有:
- 下列对有机物结构或性质的描述,错误的是( ) A.苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚弱 B.一定条件下,Cl2可...
- 不小心把苯酚沾到皮肤上,除了用酒精清洗外,还可以用的试剂是:( ) A.稀氢氧化钠溶液 B.浓溴水 C.稀盐酸 D.肥皂水
- 漆酚(烃基—C15H27链烃基),我国特产生漆的主要成分。当漆涂在物体表面,在空气中干燥时会形成黑色漆膜。对漆酚的下列说法正确...
- 下列物质中,属于酚类的是 ( )
- 下列有机反应的化学方程式中正确的是[ ]A. CH3CH2OHCH2=CH2↑+H2OB. CH3CH2Br + CH3CH2OH + NaOHCH3CH2OCH2CH3+ NaBr+H2OC. CH...
- 下列与有机物结构、性质相关的叙述正确的是( )A.在水溶液里,乙酸分子中的—CH3可以电离出H+B.甲苯和乙苯可以用酸性高锰...
- 某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,试完成下列问题:(1)烃A的分子式为________。(2)若一定量的...
- 有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得16.8 g该有机物经燃烧生成44.0 gCO2和14.4g水,质谱图表明其...
- 已知某烃A含碳元素的质量分数为85.7%.结合以下信息回答问题:(1)若烃A密度是相同状况下氢气密度的42倍.则烃A的相对分子质...
- (1)某烷烃含有200个氢原子,其分子式是______;(2)某烃0.1mol在氧气中恰好完全燃烧,将生成物先通过足量浓硫酸,浓硫酸增...