本试题 “某温度时,用惰性电极电解硝酸钠的不饱和溶液。若两极收集到气体的总体积为22.4aL时,剩余溶液恢复至原温度,析出溶质m g;若两极收集到气体总体积为33.6 a L...” 主要考查您对溶解度的计算
电化学有关的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 溶解度的计算
- 电化学有关的计算
溶解度的计算:
溶解度的计算公式:S=100m质/m剂(一定温度下的饱和溶液)
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
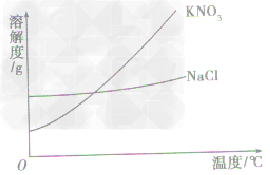
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
溶解度的计算公式:S=100m质/m剂(一定温度下的饱和溶液)
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
电化学计算的基本方法和技巧:
原电池和电解池的计算包括两极产物的定量计算、溶液的pH计算、相对原子质量的计算,根据电量求产物的量或根据产物的量求电量等。通常有下列三种方法。
1.根据电子守恒法
计算用于串联电路中阴、阳两极产物或正、负两极产物的量的计算,其依据是电路中转移的电子数相等。
2.根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
3.根据关系式计算
运用得失电子守恒建立已知量与未知量之间的关系式。如以通过4mole一为桥梁可构建电极产物之间的如下关系式: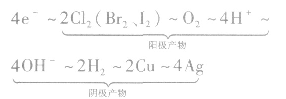
该关系式具有总揽电化学计算的作用和价值,熟记电极反应式,灵活运用这个关系式便能快速解答常见的电化学计算问题。
特别提醒:在电化学计算中,还常利用 和
和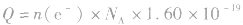 来计算电路中通过的电量。
来计算电路中通过的电量。
发现相似题
与“某温度时,用惰性电极电解硝酸钠的不饱和溶液。若两极收集到...”考查相似的试题有:
- 下列溶液中微粒的物质的量浓度关系正确的是( )A.0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)B...
- 以葡萄糖为燃料可以形成微生物燃料电池(酸性电解质体系中)。关于该电池的叙述正确的是[ ]A.该电池能够在高温下工作B.电池...
- 用铜做电极,电解某浓度的AgNO3和Cu(NO3)2的混合溶液,一段时间后,阴极上析出1.6gCu时,不考虑溶液体积变化,则下列叙述中正...
- 用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解。此时若加入100g36.5%的浓盐酸,所得溶液正好与原溶液完全...
- 电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0.1 mol Fe(OH)3沉淀时共消耗amol H2O,产生b L(标准状况)H2,则a和b分别...
- 1 L某溶液中含有的离子如下表: 用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积的变化及电极产物可能存...
- 如图所示,A池用石墨电极电解pH=13氢氧化钠溶液 100 ml),B池c电极为纯铜,d电极为粗铜(含有杂质Fe、 Ag),溶液是足量CuSO...
- 已知甲池的总反应为2CH3OH+3O2+4KOH2K2CO3+6H2O。请回答下列问题:(1)甲池是______装置,A(石墨)电极是______极。(2)写出通...
- 由铜、银和硝酸银组成的原电池工作时,正极为________;当有1.6 g铜溶解时,银棒增重_________。
- 用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量...