本试题 “某化学课外活动小组在实验室做了如下一系列实验:该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.①甲同学认为装置Ⅰ可作为实...” 主要考查您对氧化亚铁
氧化铁
四氧化三铁
氢氧化亚铁
氢氧化铁
测定物质组成、成分含量
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化亚铁
- 氧化铁
- 四氧化三铁
- 氢氧化亚铁
- 氢氧化铁
- 测定物质组成、成分含量
氧化亚铁:
(1)色态:黑色粉末
(2)溶解性:不溶于水,不与水反应,溶于盐酸、稀硫酸生成亚铁盐。
(3)稳定性:不稳定,在空气中加热时迅速被氧化成四氧化三铁
(4)氧化性:(高温下)被CO、H2、Al、C、Si等还原
(5)还原性:在空气中加热氧化为Fe3O4
氧化亚铁:
(1)色态:黑色粉末
(2)溶解性:不溶于水,不与水反应,溶于盐酸、稀硫酸生成亚铁盐。
(3)稳定性:不稳定,在空气中加热时迅速被氧化成四氧化三铁
(4)氧化性:(高温下)被CO、H2、Al、C、Si等还原
(5)还原性:在空气中加热氧化为Fe3O4
铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
氧化亚铁的化学性质:
- 铝热反应:2Al+3FeO=(高温)=Al2O3+3Fe
- 与非氧化性酸反应:FeO+2H+==Fe2++H2O
- 与氧化性酸反应:3FeO+10H++NO3-==3Fe3++NO↑+5H2O
氧化铁:
化学式Fe2O3,溶于盐酸,为红棕色粉末。其红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中,可做催化剂,玻璃、宝石、金属的抛光剂,可用作炼铁原料。
(1)色态:红色粉末,俗称铁锈(铁红)
(2)溶解性:溶于盐酸、稀硫酸生成+3价铁盐;难溶于水,不与水反应。
(3)氧化性:高温下被CO、H2、Al、C、Si等还原
氧化铁的化学性质:
- 铝热反应:2Al+Fe2O3=(高温)=Al2O3+2Fe
- 与强酸反应:Fe2O3+6H+==2Fe3++3H2O
- 与还原性酸(HI)反应:Fe2O3+6H++2I-==2Fe2++3H2O+I2
铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
四氧化三铁:
又称磁性氧化铁,具有磁性的黑色晶体,不溶于水,具有优良的导电性。
四氧化三铁的性质:
(1)色态:具有磁性的黑色晶体
(2)别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石、偏铁酸亚铁
(3)矿物:磁铁矿
(4)溶解性:不溶于水,与酸反应生成+2、+3铁盐
(5)稳定性:稳定
(6)还原性:在高温下,易氧化成三氧化二铁。4Fe3O4+O2 6Fe2O3
6Fe2O3
(7)氧化性:在高温下可与还原剂H2、CO、Al、C等反应。 


铁的氧化物:
| 化学式 | FeO | Fe2O3 | Fe3O4 |
| 俗称 | —— | 铁红 | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 铁的价态 | +2 | +3 | +2、+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 与酸反应 | FeO+2H+==Fe2++H2O | Fe2O3+6H+==2Fe3++3H2O | Fe3O4+8H+==Fe2++2Fe3++4H2O |
| 用途 | 玻璃色料 | 油漆、颜料 | 做颜料和抛光剂 |
| 氧化性 | 高温时都能与C、CO、H2反应,被还原生成Fe单质 | ||
氢氧化亚铁:
化学式为Fe(OH)2,白色固体,难溶于水,碱性较弱,可与常见酸反应;在空气中易被氧化,白色→灰绿色→红褐色。反应方程式如下:
(1)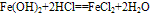
(2)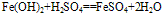
(3)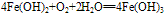
氢氧化亚铁的性质:
氢氧化亚铁极易被氧化,水中的溶解氧就可以把它氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2=△=2Fe2O3+4H2O
铁的氢氧化物:
| Fe(OH)2 | Fe(OH)3 | |
| 色态 | 白色固体 | 红褐色固体 |
| 与盐酸反应 | Fe(OH)2+2H+==Fe2++2H2O | Fe(OH)3+3H+==Fe3++3H2O |
| 热稳定性 | 在空气中加热迅速生成Fe3O4 | 2Fe(OH)3=(加热)=Fe2O3+3H2O |
| 二者的关系 | 在空气中Fe(OH)2能够非常迅速地被氧化成Fe(OH)3,现象是:白色迅速变成灰绿色,最后变成红褐色。反应方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3 | |
氢氧化亚铁的制备:
因Fe(OH)2在空气中易被氧化,4Fe(OH)2+O2+2H2O===4Fe(OH)3,故Fe(OH)2在水中不能稳定存在,在实验室制取Fe(OH)2时,一定要用新制的亚铁盐和先加热驱赶掉O2的NaOH溶液,且滴管末端要插入试管内的液面以下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2的接触。关于Fe(OH)2制备的方法很多,核心问题有两点,一是溶液中溶解的氧必须除去,二是反应过程必须与O2隔绝。
1、操作方法:在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴煤油,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,观察现象。另外,为使氢氧化亚铁的制备成功,先将硫酸亚铁溶液加热,除去溶解的氧气。
实验现象:滴入溶液到硫酸亚铁溶液中有白色絮状沉淀生成。白色沉淀放置一段时间,振荡后迅速变成灰绿色,最后变成红褐色。
注:白色沉淀:Fe(OH)2;灰绿色沉淀:Fe(OH)2和Fe(OH)3的混合物;红褐色沉淀:Fe(OH)3
方法的改进:可在液面上滴加苯或者油进行液封,可有效防止氧的溶解。
【典例】 Ⅰ.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是__________________________________________________________ ________________________________________________________
Ⅱ.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。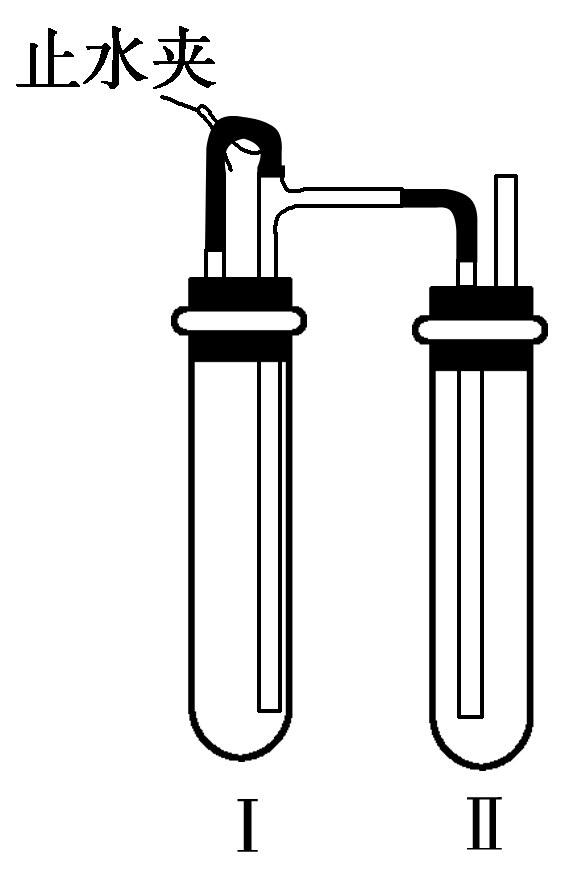
(1)在试管Ⅰ中加入的试剂是________。
(2)在试管Ⅱ中加入的试剂是________。
(3)为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_____________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,理由是_________________________________________________________________。
【答案】:Ⅰ.(1)稀H2SO4、铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2而被氧化 Ⅱ.(1)稀H2SO4和铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,故外界O2不易进入
2、电化学制备
【典例】 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所法实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
①a电极材料为_______,其电极反应式为_______________。
②电解液d可以是_______,则白色沉淀在电极上生成;也可以是_______,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
③液体c为苯,其作用是______________,在加入苯之前,对d溶液进行加热处理的目的是___________。
④为了在短时间内看到白色沉淀,可以采取的措施是____________________。
A.改用稀硫酸做电解液 B.适当增大电源电压 C.适当缩小两电极间距离 D.适当降低电解液温度
⑤若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为___________。
【答案】:①Fe;Fe-2e-=Fe2+ ②C;B ③隔绝空气防止Fe(OH)2被空气氧化;排尽溶液中的氧气,防止生成的Fe(OH)2在溶液中氧化 ④B、C ⑤白色沉淀迅速变成灰绿色,最后变成红褐色
氢氧化铁:
红褐色固体,难溶于水,易与酸反应;加热可分解生成氧化铁。反应方程式如下:
(1)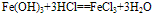
(2)
(3)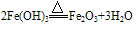
氢氧化铁胶体的制备:
操作步骤:将烧杯中的蒸馏水加热至沸腾,向沸水中滴加5~6滴饱和FeCl3溶液,继续煮沸至呈红褐色为止。
离子方程式:Fe3++3H2O=(加热)=Fe(OH)3(胶体)+3H+
铁的氢氧化物:
| Fe(OH)2 | Fe(OH)3 | |
| 色态 | 白色固体 | 红褐色固体 |
| 与盐酸反应 | Fe(OH)2+2H+==Fe2++2H2O | Fe(OH)3+3H+==Fe3++3H2O |
| 热稳定性 | 在空气中加热迅速生成Fe3O4 | 2Fe(OH)3=(加热)=Fe2O3+3H2O |
| 二者的关系 | 在空气中Fe(OH)2能够非常迅速地被氧化成Fe(OH)3,现象是:白色迅速变成灰绿色,最后变成红褐色。反应方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3 | |
定量实验介绍:

燃烧法测定氨基酸的组成:
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置进行实验。

①实验开始时,首先要通入一段时间的氧气,目的是排除体系中的N2。
②D装置的作用是吸收未反应的O2,保证最终收集的气体是N2。
③读取N2体积时,应注意:量筒内液面与广口瓶中的液面相持平视线与凹液面最低处相切。
④实验中测得N2的体积为VmL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据为生成二氧化碳气体的质量、生成水的质量、氨基酸的相对分子质量
用氨气还原氧化铜的方法测定铜的近似相对原子质量:
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
装置图:
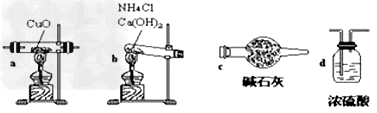
①连接顺序为:bcacd
②d中浓硫酸的作用是吸收未反应的氨、防止空气中水分进入;实验完毕时观察到a中的现象是固体由黑色转变为红色;
③Cu的相对原子质量的表达式
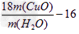
与“某化学课外活动小组在实验室做了如下一系列实验:该小组设计...”考查相似的试题有:
- (14分)(1)现有浓度各为1 mol/L的FeCl3、FeCl2、CuCl2的混合溶液100mL,加入一定量的铁粉,按下列情况填空:①充分反应后铁...
- (6分)将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器内,根据下述不同情况(填写金属或金属离子,用化学符号表示)。...
- 在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存...
- 下列图示中能较长时间看到Fe(OH)2白色沉淀的有A.Ⅰ、Ⅱ、ⅣB.Ⅰ、Ⅱ、III、Ⅳ、ⅥC.Ⅰ、III、ⅤD.Ⅰ、Ⅱ、III、Ⅳ、Ⅴ、Ⅵ
- 铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。(1)工业上可...
- 铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0...
- 有两种金属组成的合金50克,与足量氯气反应,共用去氯气71克,则该合金不可能的组成是A.锌和铜B.锌和铁C.钙和铜D.钠和铝
- 粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20gA全...
- 如图是部分元素的单质和化合物之间的相互转化关系,部分反应的生成物没有全部列出。已知原料A、M均属于金属氧化物,L是由两种...
- 江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分...