本试题 “温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH.CO2(g)+3H2(g)一定条件CH3OH(g)+H2...” 主要考查您对化学平衡常数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学平衡常数
定义:
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)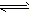 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: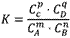
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,
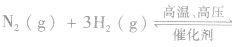


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。
化学表平衡达式:
对于可逆反应mA(g)+nB(g)
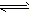 pC(g)+qD(g)来说,化学平衡表达式:
pC(g)+qD(g)来说,化学平衡表达式: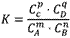
化学平衡常数的意义:
①表示该反应在一定温度下,达到平衡时进行的程度,K值越大,正反应进行的越彻底,对反应物而言转化率越高。
②某一温度下的K′与K比较能够判断反应进行的方向
K′>K,反应正向进行;K′<K,反应逆向进行;K′=K,反应处于平衡状态
(3)化学平衡常数与浓度、压强、催化剂无关,与温度有关,在使用时必须指明温度。
(4)在计算平衡常数时,必须是平衡状态时的浓度。
(5)对于固体或纯液体而言,其浓度为定值,可以不列入其中。
(6)化学平衡常数是指某一具体反应的平衡常数,若反应方向改变,则平衡常数改变,且互为倒数关系。如:在一定温度下,


化学平衡常数的应用:
1.K值越大,说明平衡体系中生成物所占的比例越大,正向反应进行的程度越大,反应物转化率越大;反之,正向反应进行的程度就越小,反应物转化率就越小,即平衡常数的大小可以衡量反应进行的程度,判断平衡移动的方向,进行平衡的相关计算。
2.若用浓度商(任意状态的生成物浓度幂之积与反应物浓度幂之积的比值,符号为Qc)与K比较,可判断可逆反应是否达到平衡状态和反应进行的方向。
3.利用K值可判断反应的热效应若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.计算转化率及浓度依据起始浓度(或平衡浓度)和平衡常数可以计算平衡浓度(或起始浓度),从而计算反应物的转化率。
发现相似题
与“温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂...”考查相似的试题有:
- 现向一密闭容器中充入1 mol N2和 3 mol H2,在一定条件下开始反应。下列有关说法中正确的是( )A.达到化学平衡时,将生成2 mo...
- 相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2...
- 可以证明可逆反应N2+ 3H22NH3已达到平衡状态的是①一个N≡N断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断...
- 联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。(1)已知:2NO2(g)=N2O4(g) △H=-57. 20 kJ/mol...
- 碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)WI2(g) ΔH<0(温度T1...
- 己知反应A(s)+B(g)C(g)+D(g)的化学平衡常数和温度的关系如下:温度(℃)70080083010001200化学平衡常数1.71.11.00.60.4 下列...
- 一定温度下,可逆反应X(g)+3Y(g)2Z(g)达到平衡的标志是A.正反应速率等于逆反应速率,且不等于零B.X的浓度不再发生变化C....
- 下列事实不能用勒夏特列原理解释的是A.开启啤酒瓶后,瓶中马上泛起大量泡沫B.光照氯水,颜色变浅C.工业上生产硫酸的过程中...
- 合成氨工厂常通过测定反应前后混合气体的密度来确定氮的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状...
- 反应CO(g)+NO2(g)CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升...