本试题 “有A、B、C、D四种元素,B的单质B2在常温下是气体;B和C两元素都能跟元素D化合分别形成共价化合物DB和D2C,D2C在常温下是液体,A、B、C三种元素能形成化合物AB...” 主要考查您对化学反应方程式的意义
元素符号的意义及写法
元素的定义
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应方程式的意义
- 元素符号的意义及写法
- 元素的定义
化学方程式的概念:
用化学式来表示化学反应的式子。如C+O2 CO2是碳充分燃烧的化学方程式。
CO2是碳充分燃烧的化学方程式。
化学方程式的意义、读法:
(1)化学方程式的意义
化学方程式还能表示化学反应的类型。如化学方程式Zn+H2SO4==ZnSO4+H2↑是一个置换反应。
(2)化学方程式的三种读法
化学方程式中“+”和“=”虽与数学中的“+”和 “=”形式一样,但其意义却不相同。化学方程式中的 “+”,读时不读“加”而是读“和”或“与”;化学方程式中的“=”也不同于数学意义上的“=”,它表示“生成” 的意思,同时表明在化学反应前后有两个不变:原子种类不变,每种原子的总个数也不变,“=”读作“反应生成”,而不能读作“等于”。 一个化学方程式往往有三种读法,现以2H2O 2H2↑+O2↑为例加以说明。
2H2↑+O2↑为例加以说明。
①质的方面:在通电的条件下,水分解生成氢气和氧气。这种读法说明了化学反应中物质的变化,能表示出反应物、生成物、反应条件。
②粒子方面:在通电的条件下,每2个水分子分解生成2个氢分子和1个氧分子。这种读法揭示了化学反应中物质拉子结构的变化,并反映出粒子个数的比例关系。
③量的方面:在通电的条件下,36份质量的水分解生成4份质量的氢气和32份质量的氧气。这种读法表明了化学反应前后物质的质量守恒关系。
用化学式来表示化学反应的式子。如C+O2
 CO2是碳充分燃烧的化学方程式。
CO2是碳充分燃烧的化学方程式。 化学方程式的意义、读法:
(1)化学方程式的意义
| 意义 | 实例C+O2 CO2 CO2 |
| (质的方面)表示反应物、生成物和反应条件 | |
| (量的方面) ①表示反应物、生成物之间的质量比各物质间 质量比=相对分子质最与化学计量数的乘积比 ②表示反应物、生成物之间的微粒个数比,即 化学式前的化学计量数之比 |
C+O2 CO2 CO2(12×1):(32×1):(41×1) C+O2  CO2 CO21:1:1 |
(2)化学方程式的三种读法
化学方程式中“+”和“=”虽与数学中的“+”和 “=”形式一样,但其意义却不相同。化学方程式中的 “+”,读时不读“加”而是读“和”或“与”;化学方程式中的“=”也不同于数学意义上的“=”,它表示“生成” 的意思,同时表明在化学反应前后有两个不变:原子种类不变,每种原子的总个数也不变,“=”读作“反应生成”,而不能读作“等于”。 一个化学方程式往往有三种读法,现以2H2O
 2H2↑+O2↑为例加以说明。
2H2↑+O2↑为例加以说明。 ①质的方面:在通电的条件下,水分解生成氢气和氧气。这种读法说明了化学反应中物质的变化,能表示出反应物、生成物、反应条件。
②粒子方面:在通电的条件下,每2个水分子分解生成2个氢分子和1个氧分子。这种读法揭示了化学反应中物质拉子结构的变化,并反映出粒子个数的比例关系。
③量的方面:在通电的条件下,36份质量的水分解生成4份质量的氢气和32份质量的氧气。这种读法表明了化学反应前后物质的质量守恒关系。
表示方法:
为了书写和学术交流的方便,采用国际统一的符号来表示各种元素,如:氢元素用“H”来表示,铁元素用“Fe”来表示等。
元素符号的写法:
①由一个字母表示的元素符号要大写,如:H、C、 S、P,K。
②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如:Na、Mg、 Ca、Zn、Si。
为了书写和学术交流的方便,采用国际统一的符号来表示各种元素,如:氢元素用“H”来表示,铁元素用“Fe”来表示等。
元素符号的写法:
①由一个字母表示的元素符号要大写,如:H、C、 S、P,K。
②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如:Na、Mg、 Ca、Zn、Si。
元素符号和化学式的关系:
| 化学用语 | 元素符号 | 化学式 | |
| 意义 | 宏观 | 表示一种元素 表示一种物质(由原子构成的物质) |
表示这种物质 表示这种物质由几种元素组成 |
| 微观 | 表示该元素的一个原子 | 表示这种物质的一个分子〔由分子构成的物质) 表示一个分子含有各原子的个数(由分子构成的物质) | |
| 量的意义 | —— | 表示这种物质的相对分子质量 表示这种物质中各元素的原子个数比和质量之比 表示物质中各组成元素的质量分数 | |
| 举例 | H 表示氢元素 表示一个氢原子 |
H2O 表示水 表示水是由氢元素和氧元素组成的 表示1个水分子 表示1个水分子中含有2个氢原子和1个氧原子 | |
| 注意事项 | 单独的化学式和元素符号,既有宏观意义,又有微观意义化学式和元素符号前加上数字,则只表示微观意义,即只表示相应的粒子个数,如“2H”表示两个氢原子,"3H2O"表示三个水分子化学式中元素符号右下角的数字表示每个分子中所含该元素原子的个数,如“CO2”中的”2”表示一个二氧化碳分子中含有两个氧原子 | ||
概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;
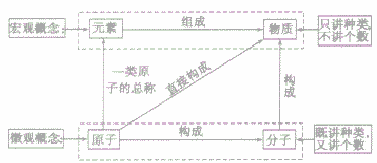
在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
对元素概念的理解:
①元素是以核电荷数(即核内质子数)为标准对原子进行分类。只讲种类,不讲个数。
②质子数是划分元素种类的标准。质子数相同的原子和单核离子都属于同一种元素。如Na+与Na都属于钠元素,但Na+与NH4+不属于同一种元素。
③同种元素可以有不同的存在状态。如游离态和化合态。
④同种元素的离子因带电荷数不同,性质也不同。如Fe2+与Fe3+。
⑤同种元素的原子可以是不同种原子。如碳元素有三种不同中子数的碳原子:612C、613C、614C.
元素与原子的比较
| 元素 | 原子 | |
| 概念 | 具有相同核电荷数〔即核内质子数)的一类原子的总称 | 化学变化中的最小粒子 |
| 区分 | 只讲种类,不讲个数 | 既讲种类,又讲个数 |
| 使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
| 举例 | 水由氢元素和氧元素组成,或说水中含有氢元素和氧元素 | 每个水分子由两个氢原子和一个氧原子构成 |
| 联系 | 元素和原子是总体和个体的关系,原子是元素的个体,是构成并体现元素性质的最小微粒;元素是一类原子的总称一种元素可以包含几种原子 | |
元素、原子、分子与物质间的关系:
物质的组成可以从宏观和微观两个方面进行描述,其中元素是从宏观上对物质组成的描述,分子、原子是从微观上对物质构成的描述。其关系如下图;

在讨论物质的组成和结构时,应注意规范地运用这些概念,现举例如下:
(1)由分子构成的物质,有三种说法(以二氧化碳为例):
①二氧化碳是由氧元素和碳元素组成的。
②二氧化碳是由二氧化碳分子构成的。
③每个二氧化碳分子是由2个氧原子和I个碳原子构成的。
(2)由原子(或离子)直接构成的物质(如汞、食盐),有两种说法:
①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的。
②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的。
同位素:
同位素指具有相同的质子数,但中子数不同的同一元素的不同原子,如氢有3种同位素,分别称为氕(H)、氘(D)、氚T),即原子核内质子数均为1,但中子数分别为0,1,2的氢原子。同位素有天然存在的,也有人工合成的。同一元素的同位素虽然中子数不同,但它们的化学性质基本相同。
发现相似题
与“有A、B、C、D四种元素,B的单质B2在常温下是气体;B和C两元素...”考查相似的试题有:
- (2分)长途运输鱼苗,常用过氧化钙(CaO2)作供氧剂,过氧化钙在水中能缓慢溶解,并跟水反应生成一种微溶的碱和氧气,反应的...
- Ⅰ.干电池的主要成分是锌、石墨、二氧化锰和氯化铵等。请回答下列问题:⑴石墨做为电极是利用它的 性;⑵二氧化锰(MnO2)中锰元素...
- 化学方程式不能提供的信息是( )A.通过什么条件反应B.哪些物质参加反应C.各物质之间的质量比D.化学反应速率的快慢
- 阿司匹林(化学式为C9H8O4)是一种常见的解热镇痛药.下列说法正确的是( )A.阿司匹林中含有24个原子B.阿司匹林属于有机高...
- 纯净物A可用作气体燃料。在一定条件下,将一定质量的A与160g B按下图所示充分反应,当B反应完全时,生成176gC和36gD.(1)参...
- 请完成下列反应的化学方程式:⑴氢气在氧气中燃烧 __________________________________⑵古代湿法炼铜的原理(铁与硫酸铜溶液反...
- 写出下列元素的名称和符号:元素符号F______Pb______Cl元素名称______硅______氖______
- 元素的种类不同是由原子的_______决定的。
- 结构决定性质请写出导致下列物质性质差异的因素①一氧化碳具有可燃性而二氧化碳不具有可燃性因为它们:______不同;②FeSO4为绿...
- 近年来我国猪肉及其制品受“瘦肉精”影响的事件多有报道,其中“双汇瘦肉精”事件影响最大.“瘦肉精”学名盐酸克伦特罗,分子式为C...