本试题 “2009年2月20日6:20分左右江苏省盐城市许多市民在饮用自来水时闻到刺鼻的农药味。经检测,该市城西自来水厂的水源受到盐城市标新化工有限公司排放的酚类化合...” 主要考查您对关于溶液的计算
有机化合物和无机化合物
物质组成元素的质量比
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 关于溶液的计算
- 有机化合物和无机化合物
- 物质组成元素的质量比
溶质质量分数:
1. 概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2. 表达式:
溶质质量分数= =
=
3. 含义:溶质质量分数的含义是指每100份质量的溶液中含有溶质的质份为多少。如100g10%的NaCl溶液中含有10gNaCl.。不要误认为是100g水中含有10gNaCl。
应用溶质质量分数公式的注意事项:
①溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不在考虑范围之内。如在20℃时,100g水中最多能溶解36gNaCl,则20gNaCl放入50g 水中溶解后,溶质的质量只能是18g。
②溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和(可以是一种或几种溶质)。
③计算时质量单位应统一。
④由于溶液的组成是指溶液中各成分在质量方面的关系,因此,对溶液组成的变化来说,某物质的质量分数只有在不超过其最大溶解范围时才有意义。
例如在20℃时,NaCl溶液中溶质的质量分数最大为26.5%,此时为该温度下氯化钠的饱和溶液,再向溶液中加入溶质也不会再溶解,浓度也不会再增大。因此离开实际去讨论溶质质量分数更大的NaCl溶液是没有意义的。
⑤运用溶质质量分数表示溶液时,必须分清溶质的质量、溶剂的质量和溶液的质量。
a.结晶水合物溶于水时,其溶质指不含结晶水的化合物。如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数= ×100%
×100%
b.当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数= 。
。
c.若两种物质能发生反应,有沉淀或气体生成,此时溶液中的溶质质量分数=
影响溶质质量分数的因素:
(1)影响溶质质量分数的因素是溶质、溶剂的质录,与温度、是否饱和无关。在改变温度的过程中若引起溶液中溶质、溶剂质量改变,溶质的质量分数也会改变,但归根结底,变温时必须考虑溶质、溶剂的质量是否改变。因而,影响溶质的质量分数的因素还是溶质、溶剂的质量。例如:
①将饱和的NaNO3溶液降低温度,由于析出品体,溶液中溶质的质缺减少,溶剂的质量不变,所以溶液中溶质的质量分数变小。
②将饱和的NaNO3溶液升高温度,只是溶液变成了不饱和溶液,溶液中溶质、溶剂的质量不变,因而溶液中溶质的质量分数不变。
(2)不要认为饱和溶液变成不饱和溶液,溶质的质量分数就变小;也不要认为不饱和溶液变成饱和溶液,溶质的质量分数就变大;要具体问题具体分析。
有关溶质质量分数计算的类型
(1)利用公式的基本计算
①已知溶质、溶剂的质量,求溶质的质量分数。
直接利用公式:溶质的质量分数= ×100%
×100%
②已知溶液、溶质的质量分数,求溶质、溶剂的质量。
利用公式:溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量一溶质的质量
③已知溶质的质量、溶质的质量分数,求溶液的质量。
利用公式:溶液的质量=溶质的质量÷溶质的质量分数
④质量、体积、密度与溶质质量分数的换算
当溶液的量用体积表示时,计算时应首先将溶液的体积换算成质量后再进行相关计算。因为计算溶质的质量分数的公式中各种量都是以质量来表示的,不能以体积的数据来代替。
利用公式:溶液的质量=溶液的体积×溶液的密度
(2)溶液的稀释与浓缩
注意:
a.几种溶液混合,溶液的体积不能简单相加,即V总≠VA+VB
b.混合后溶液的质量、溶质的质量可以相加,即m总=mA+mB
c. 要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
(3)饱和溶液中溶质质量分数的计算
a. 固体溶解度的计算公式
根据固体溶解度的计算公式[溶解度(S)= ×100g]可推导出:
×100g]可推导出: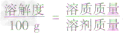 ,
,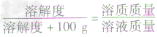
b. 溶解度与溶质质量分数的关系
特殊的溶质质量分数的计算:
(1)结晶水合物溶于水时,其溶质指不含结晶水的化合物。
如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数= ×100%
×100%
(2)溶质只能是已溶解的那一部分,没有溶解的不能做溶质计算
如20℃时,20gNaCl投入到50g中水中(20℃时,NaCl的溶解度为36g)。20℃时50g水最多只能溶解18gNaCl,如溶质的质量为18g,而不是20g,所以该NaCl溶液的质量分数=18g/(50g+18g)×100%=26.5%。
(3)当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数= 。
。
(4)某混合物溶于水,要计算某一溶质的质量分数,溶液的质量包括混合物与水的质量
如5gNaCl和1gKNO3的混合物溶于100g水,计算NaCl的溶质质量分数:
ω(NaCl)=5g/(5g+1g+100g)×100%=4.7%。
(5)利用元素的质量分数进行计算
溶液中溶质的质量分数与溶质中某元素的质量分数之间有着联系。溶液的溶质质量分数×溶质中某元素的质量分数=溶液中某元素的质量分数。
溶质质量分数的不变规律:
(1)从一瓶溶液中不论取出多少溶液,取出溶液及剩余溶液的溶质质量分数与原来溶液中溶质质量分数相同。
(2)溶质、溶质质量分数均相同的两种溶液混合,所得溶液的质量分数保持不变。
(3)一定温度时,向某饱和溶液中加入该溶质,所得溶液的溶质质量分数保持不变。
(4)一定温度时,对某饱和溶液恒温蒸发溶剂,所得溶液的溶质质量分数保持不变。
(5)对于溶解度随温度升高而增大的物质来说,将其饱和溶液(底部没有固体时)升高温度,所得溶液的溶质质量分数保持不变。而对于溶解度随温度升高而减小的物质(熟石灰)来说,降低温度,所得溶液的溶质质量分数保持不变。
1. 概念:溶液中溶质的质量分数是溶质质量与溶液质量之比。
2. 表达式:
溶质质量分数=
 =
=
3. 含义:溶质质量分数的含义是指每100份质量的溶液中含有溶质的质份为多少。如100g10%的NaCl溶液中含有10gNaCl.。不要误认为是100g水中含有10gNaCl。
应用溶质质量分数公式的注意事项:
①溶质的质量是指形成溶液的那部分溶质,没有进入溶液的溶质不在考虑范围之内。如在20℃时,100g水中最多能溶解36gNaCl,则20gNaCl放入50g 水中溶解后,溶质的质量只能是18g。
②溶液的质量是该溶液中溶解的全部溶质的质量与溶剂的质量之和(可以是一种或几种溶质)。
③计算时质量单位应统一。
④由于溶液的组成是指溶液中各成分在质量方面的关系,因此,对溶液组成的变化来说,某物质的质量分数只有在不超过其最大溶解范围时才有意义。
例如在20℃时,NaCl溶液中溶质的质量分数最大为26.5%,此时为该温度下氯化钠的饱和溶液,再向溶液中加入溶质也不会再溶解,浓度也不会再增大。因此离开实际去讨论溶质质量分数更大的NaCl溶液是没有意义的。
⑤运用溶质质量分数表示溶液时,必须分清溶质的质量、溶剂的质量和溶液的质量。
a.结晶水合物溶于水时,其溶质指不含结晶水的化合物。如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数=
 ×100%
×100%b.当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数=
 。
。c.若两种物质能发生反应,有沉淀或气体生成,此时溶液中的溶质质量分数=

影响溶质质量分数的因素:
(1)影响溶质质量分数的因素是溶质、溶剂的质录,与温度、是否饱和无关。在改变温度的过程中若引起溶液中溶质、溶剂质量改变,溶质的质量分数也会改变,但归根结底,变温时必须考虑溶质、溶剂的质量是否改变。因而,影响溶质的质量分数的因素还是溶质、溶剂的质量。例如:
①将饱和的NaNO3溶液降低温度,由于析出品体,溶液中溶质的质缺减少,溶剂的质量不变,所以溶液中溶质的质量分数变小。
②将饱和的NaNO3溶液升高温度,只是溶液变成了不饱和溶液,溶液中溶质、溶剂的质量不变,因而溶液中溶质的质量分数不变。
(2)不要认为饱和溶液变成不饱和溶液,溶质的质量分数就变小;也不要认为不饱和溶液变成饱和溶液,溶质的质量分数就变大;要具体问题具体分析。
有关溶质质量分数计算的类型
(1)利用公式的基本计算
①已知溶质、溶剂的质量,求溶质的质量分数。
直接利用公式:溶质的质量分数=
 ×100%
×100% ②已知溶液、溶质的质量分数,求溶质、溶剂的质量。
利用公式:溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量一溶质的质量
③已知溶质的质量、溶质的质量分数,求溶液的质量。
利用公式:溶液的质量=溶质的质量÷溶质的质量分数
④质量、体积、密度与溶质质量分数的换算
当溶液的量用体积表示时,计算时应首先将溶液的体积换算成质量后再进行相关计算。因为计算溶质的质量分数的公式中各种量都是以质量来表示的,不能以体积的数据来代替。
利用公式:溶液的质量=溶液的体积×溶液的密度
(2)溶液的稀释与浓缩
| 方法 | 计算依据 | 计算公式 | |
| 溶液的稀释 | ①加水稀释 ②加稀溶液稀释 |
①加水稀释前后,溶液中溶质的质量不变 ②用稀溶液稀释浓溶液时。稀溶液中溶质的质量与浓溶液中溶质的质量之和等于混合后溶液中溶质的质量 |
加水稀释:稀释前后溶液中溶质的质量不变 m浓×ω浓%=(m浓+m水)×ω稀% |
| 溶液的浓缩 | ①添加溶质 ②蒸发溶剂 ③加入浓溶液 | ①原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中的溶质质量 ②蒸发溶剂前后溶液中溶质的质量不变(没有溶质析出) ③原溶液中的溶质与后加入浓溶液中的溶质质量之和等于混合后溶液中的溶质质量 |
蒸发浓缩:浓缩前后溶液中溶质的质量不变(m稀-m水)×ω浓%=m稀×ω稀% |
a.几种溶液混合,溶液的体积不能简单相加,即V总≠VA+VB
b.混合后溶液的质量、溶质的质量可以相加,即m总=mA+mB
c. 要求混合后溶液的总体积,必须依据公式V=m/ρ,所以要知道混合溶液的密度才能求出总体积。
(3)饱和溶液中溶质质量分数的计算
a. 固体溶解度的计算公式
根据固体溶解度的计算公式[溶解度(S)=
 ×100g]可推导出:
×100g]可推导出: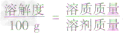 ,
,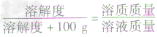
b. 溶解度与溶质质量分数的关系
| 溶解度 | 溶质质量分数 | |
| 意义 | 物质溶解性的量度,受外界温度的影响 | 表示溶液中溶质质量的多少,不受外界条件影响 |
| 容积要求 | 100g | 无要求 |
| 温度要求 | 与温度有关 | 一般与温度无关 |
| 溶液是否饱和 | 一定达到饱和 | 不一定饱和 |
| 计算公式 |  ×100g ×100g |
 |
| 单位 | 克 | 无单位 |
| 联系 | 饱和溶液中溶质的质量分数= | |
特殊的溶质质量分数的计算:
(1)结晶水合物溶于水时,其溶质指不含结晶水的化合物。
如CuSO4·5H2O溶于水时,溶质是CuSO4。
溶质质量分数=
 ×100%
×100%(2)溶质只能是已溶解的那一部分,没有溶解的不能做溶质计算
如20℃时,20gNaCl投入到50g中水中(20℃时,NaCl的溶解度为36g)。20℃时50g水最多只能溶解18gNaCl,如溶质的质量为18g,而不是20g,所以该NaCl溶液的质量分数=18g/(50g+18g)×100%=26.5%。
(3)当某些化合物溶于水时与水发生了反应,此时溶液中的溶质是反应后生成的物质。如Na2O溶于水时发生如下反应:Na2O+H2O==2NaOH。反应后的溶质是NaOH,此
溶液的溶质质量分数=
 。
。(4)某混合物溶于水,要计算某一溶质的质量分数,溶液的质量包括混合物与水的质量
如5gNaCl和1gKNO3的混合物溶于100g水,计算NaCl的溶质质量分数:
ω(NaCl)=5g/(5g+1g+100g)×100%=4.7%。
(5)利用元素的质量分数进行计算
溶液中溶质的质量分数与溶质中某元素的质量分数之间有着联系。溶液的溶质质量分数×溶质中某元素的质量分数=溶液中某元素的质量分数。
溶质质量分数的不变规律:
(1)从一瓶溶液中不论取出多少溶液,取出溶液及剩余溶液的溶质质量分数与原来溶液中溶质质量分数相同。
(2)溶质、溶质质量分数均相同的两种溶液混合,所得溶液的质量分数保持不变。
(3)一定温度时,向某饱和溶液中加入该溶质,所得溶液的溶质质量分数保持不变。
(4)一定温度时,对某饱和溶液恒温蒸发溶剂,所得溶液的溶质质量分数保持不变。
(5)对于溶解度随温度升高而增大的物质来说,将其饱和溶液(底部没有固体时)升高温度,所得溶液的溶质质量分数保持不变。而对于溶解度随温度升高而减小的物质(熟石灰)来说,降低温度,所得溶液的溶质质量分数保持不变。
有机化合物:
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
有机化合物与无机化合物的主要区别:
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
(1)概念:通常人们将含有碳元素的化合物称为有机化合物,简称有机物,如甲烷、乙醇、葡萄糖、淀粉等。
(2)组成和结构:有机物都含碳元素,多数含有氢元素,可能还含有氧、氮、氯、硫、磷等元素。有机物中碳原子不仅可以和H,O,Cl,,N等原子直接结合,而且碳原子之间也可以互相连接成链状或环状。原子的排列方式不同,形成有机物的结构就不同,所表现出来的性质也不同。
(3)特点:大多数有机化合物都难溶于水,易溶于有机溶剂,大多数有机化合物受热易分解,且容易燃烧,燃烧产物有CO2和水;绝大多数有机化合物不易导电、熔点低。
(4)分类:
①有机物小分子:相对分了质量较小,如乙醇,甲烷、葡萄糖等。
②有机高分子化合物:简称有机高分子,其相对分子质量比较大,从几万到几十万,甚至高达几百万或更高,如淀粉、蛋白质等。
无机化合物:
(1)概念:无机化合物简称无机物,通常指不含碳元素的化合物,但少数含碳元素的化合物,如CO,CO2, H2CO3,CaCO3等,不具有有机化合物的特点,归在无机化合物中。
(2)分类:无机化合物根据元素组成及在水中离解成的粒子特点分为氧化物、酸、碱,盐。
氧化物,酸,碱,盐的比较:
| 物质类别 | 概念 | 分类 |
| 氧化物 | 由两种元素组成,期中一种是氧元素 | 金属氧化物:由金属元素与氧元素组成,如MgO,Fe2O3等 非金属氧化物:由非金属元素与氧元素组成,如CO2、SO2、H2O等 |
| 酸 | 能离解成氢离子和酸根离子的化合物 | 含氧酸:如H2SO4、H2CO3、HNO3等无氧酸:如HCl,H2S等 |
| 碱 | 由金属离子和氢氧根离子构成的化合物 | 可溶性碱:如NaOH,Ca(OH)2等不溶性碱:如Mg(OH)2、 Fe(OH)3等 |
| 盐 | 由金属离子(或铵根离子)和酸根离子构成的化合物 | 正盐:如NaCl、NH4Cl、Na2CO3,仅由金属离子或钱根离子和酸根离子两部分组成酸式盐:如NaHCO3、NH4HCO3,由金属离子或铵根离子、酸式酸根离子构成碱式盐;如Cu2(OH)2CO3,由金属离子、酸根离子和氢氧根离子构成 |
有机化合物与无机化合物的主要区别:
| 有机化合物 | 无机化合物 | |
| 溶解性 | 多数不溶于水。易溶于有机溶剂 | 有些溶于水而不溶于有机溶剂 |
| 耐热性 | 多数不耐热。熔点较低,一般在400℃ 以下 | 多数耐热,难熔化,熔点一般比较高 |
| 可燃性 | 多数可以燃烧 | 多数不能燃烧 |
概念的理解:
像NaCl、H2SO4和NaOH等不含碳元素的化合物称为无机化合物,而少数含碳元素的化合物,如CO,CO2和CaCO3等虽然含有碳元素,但具有无机化合物的特点,也把它们看作无机化合物。有机物一定含有碳元素,但含有碳元素的化合物不一定是有机物。含有碳元素但不属于有机物的化合物主要包括: 碳的氧化物、碳酸、碳酸盐和碳酸氢盐。
定义:
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=
(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为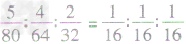 =1:1:1
=1:1:1
利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
化合物里各元素的质量比是原子个数与相对原子质量的乘积之比。即各元素原子的相对原子质量总和之比。计算的关键在于正确判断出各元素的原子总数。
公式:
各元素的质量比=各元素相对原子质量与相应原子个数的乘积之比。如化学式为AmBn的物质中,A、B两元素的质量比 =(A的相对原子质量×m):(B的相对原子质量×n)。
对概念公式的理解:
(1)元素是宏观概念,只讲种类,不讲个数。用元素符号表示时,7C素符号前后都不能写数字,如计算四氧化三铁(Fe3O4)中铁元素和氧元素的质量比时不能写成3Fe:4O
(2)在化学式中,原子个数比等于元素的质量除以其相对原子质量之比。如AmBn中A,B两元素的质量比为M:N,则化学式中A,B两元素的原子个数比m:n=

(3)当化学式中含有多种元素时,根据化学式可以计算出全部元素的质量比,也可以计算出其中某几种元素的质量比。
化学式中元素质量比的变式运算:
在AmBn中元素A,B的质量比等于各元素的相对原子质m与原子个数的乘积比,即A,B元素质量比= (A的相对原子质量×m):(B的相对原子质量×n),根据元素质量比的变形运算主要有:
(1)根据某化合物中元素的质最比求化学式根据化合物中元素的质量比(或元素的质量分数比)求化学式,其方法是通过元素的相对原子质量来推断化学式。通过组成元素质量比或元素的质量分数进行分式变换,转换成原子个数(比),推测化学式。
(2)根据某化合物中元素的质量比确定元素的化合价已知某化合物中元素的质量比确定某元素的化合价,可通过元素的质量比及元素的相对原子质量推断化学式中元素的原子个数之比,再根据化合物中正负化合价代数和为零的原则确定元素的化合价。
(3)根据元素的质量比确定元素的相对原子质量
化合物中元素的质量比等于相对原子质量与原子个数的乘积比,利用元素的质量比及化合物中各原子的个数即可求出元素的相对原子质量。相对原子质量之比等于元素的质量除以其原子个数所得的数值之比。
(4)物质的质量比与分子个数比之间的换算:
换算关系:物质的质量比
 分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为
分子个数比、如SO3、SO2、O2三种物质的质量比为5:4:2,则SO3、SO2、O2的分子个数比为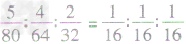 =1:1:1
=1:1:1利用化学式变形求物质的质量比:
例:含有相同质量铁元素的Fe2O3和Fe3O4的质量比是多少?
解析:设含有相同质量铁元素的Fe2O3和Fe3O4的质量分别为x,y,为了使两者含铁元素的质量相等,可以将它们的化学式变形为铁原子数目相等的式子:
Fe2O3→Fe6O9 Fe3O4→Fe6O8
480 464
x y
x:y=480:464=30:29
答案:30:29
发现相似题
与“2009年2月20日6:20分左右江苏省盐城市许多市民在饮用自来水...”考查相似的试题有:
- 硫酸溶液20克与32.33克氯化钡溶液恰好完全反应,得到50克溶液,则反应后溶液的百分比浓度为_________.
- 在20℃时,一瓶某溶质的饱和溶液中,加入一些该溶质的晶体,则( )A.晶体质量减少B.溶质的质量分数增大C.晶体质量不变D....
- 如图是甲、乙、丙三种固体物质的溶解度曲线.请回答下列问题:(1)______℃时,甲、丙两种物质的溶解度相等;(2)Q点表示的...
- 现有一瓶质量分数为20%的某溶液,倒出3/4体积后再加水,直到所得溶液质量和原来溶液的质量相等,又倒出2/3体积,最后剩下溶液...
- 下图是甲、乙、丙三种物质的溶解度曲线。下列说法正确的是[ ]A.甲物质的溶解度最大B.t3℃时甲物质溶液的溶质质量分数最大C....
- 食醋是家庭常用的调味品.某同学欲探究食醋中醋酸的质量分数.该同学进行了这样的实验:取10%的氢氧化钠溶液(密度为1.1g/mL...
- 为了测定黄铜屑(有锌和铜形成的合金)样品组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL),...
- 2009年4月,在墨西哥、美国等地出现甲型H1N1流感疫情后,引起全世界的关注,我国也陆续发现了几十例输入性甲型H1N1流感病例和...
- 2011年5月1日起,国家加大了对醉酒驾驶的处罚力度.酒中都含有乙醇,其化学式为C2H5OH.下列叙述中正确的是 ( )A.乙醇属于...
- 瘦肉精是一类对人体健康危害极大的化学物质,政府已严禁在猪饲料中添加瘦肉精.常见的瘦肉精化学式为C12H18OCl2N2,下列有关...