本试题 “如图为晶体M(不含结晶水)的溶解度曲线,a、b两点分别表示M物质的溶液.下列有关说法或a、b间的转化方法错误的是( )A.t2℃时,a是饱和溶液,b是不饱和溶液...” 主要考查您对蒸发
结晶
蒸馏
饱和溶液,不饱和溶液
固体溶解度
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 蒸发
- 结晶
- 蒸馏
- 饱和溶液,不饱和溶液
- 固体溶解度
定义:
液体温度低于沸点时,发生在液体表面的汽化过程,在任何温度下都能发生。蒸发量通常用蒸发掉的水层厚度的毫米数表示。
影响蒸发快慢的因素:
温度、湿度、液体的表面积、液体表面的空气流动等。
仪器:
铁架台(带铁圈)、酒精灯、玻璃棒、蒸发皿。
装置:

原理:
用加热的方法,使溶剂不断挥发而析出晶体,这是常用的一种结晶方法。
影响因素:
温度、湿度、液体的表面积、液体表面上方的空气流动的速度等。
主要因素:
(1)温度。温度越高,蒸发越快。因为在任何温度下,分子都在不断地运动,液体中总有一些速度较大的分子能蒸发仪器蒸发皿蒸发仪器蒸发皿够飞出液面脱离束缚而成为汽分子,所以液体在任何温度下都能蒸发。液体的温度升高,分子的平均动能增大,速度增大,从液面飞出去的分子数量就会增多,所以液体的温度越高,蒸发得就越快。
(2)液面表面积大小。如果液体表面面积增大,处于液体表面附近的分子数目增加,因而在相同的时间里,从液面飞出的分子数量就增多,所以液面面积越大,蒸发速度越快。
(3)液体表面上方空气流动的速度。当飞入空气里的汽分子和空气分子或其他汽分子发生碰撞时,有可能被碰回到液体中来。如果液面上方空气流动速度快,通风好,分子重新返回液体的机会越小,蒸发就越快。
注意事项:
①加热时要用玻璃棒不断地搅拌.防止液体局部温度过高,而发生飞溅;
⑦当蒸发皿里出现较多量同体时,停止加热,利用余热将水分蒸干;
③刚加热完与匕的蒸发皿不能用手拿取,也不能用冷水冲洗;
④如果要用烧杯浓缩溶液,加热时要垫上石棉网,以防烧杯受热小均匀而破裂。
操作口诀:
皿中液体不宜多,防止飞溅要搅动。
较多固体析出时,移去酒灯自然蒸。
液体温度低于沸点时,发生在液体表面的汽化过程,在任何温度下都能发生。蒸发量通常用蒸发掉的水层厚度的毫米数表示。
影响蒸发快慢的因素:
温度、湿度、液体的表面积、液体表面的空气流动等。
仪器:
铁架台(带铁圈)、酒精灯、玻璃棒、蒸发皿。
装置:

原理:
用加热的方法,使溶剂不断挥发而析出晶体,这是常用的一种结晶方法。
影响因素:
温度、湿度、液体的表面积、液体表面上方的空气流动的速度等。
主要因素:
(1)温度。温度越高,蒸发越快。因为在任何温度下,分子都在不断地运动,液体中总有一些速度较大的分子能蒸发仪器蒸发皿蒸发仪器蒸发皿够飞出液面脱离束缚而成为汽分子,所以液体在任何温度下都能蒸发。液体的温度升高,分子的平均动能增大,速度增大,从液面飞出去的分子数量就会增多,所以液体的温度越高,蒸发得就越快。
(2)液面表面积大小。如果液体表面面积增大,处于液体表面附近的分子数目增加,因而在相同的时间里,从液面飞出的分子数量就增多,所以液面面积越大,蒸发速度越快。
(3)液体表面上方空气流动的速度。当飞入空气里的汽分子和空气分子或其他汽分子发生碰撞时,有可能被碰回到液体中来。如果液面上方空气流动速度快,通风好,分子重新返回液体的机会越小,蒸发就越快。
注意事项:
①加热时要用玻璃棒不断地搅拌.防止液体局部温度过高,而发生飞溅;
⑦当蒸发皿里出现较多量同体时,停止加热,利用余热将水分蒸干;
③刚加热完与匕的蒸发皿不能用手拿取,也不能用冷水冲洗;
④如果要用烧杯浓缩溶液,加热时要垫上石棉网,以防烧杯受热小均匀而破裂。
操作口诀:
皿中液体不宜多,防止飞溅要搅动。
较多固体析出时,移去酒灯自然蒸。
结晶定义:
水的结晶
1、物质从液态(溶液或溶融状态)或气态形成晶体的过程。
2、晶体,即原子、离子或分子按一定的空间次序排列而形成的固体。也叫结晶体。
结晶方法:
一般为两种,一种是蒸发结晶,一种是降温结晶。
1、蒸发结晶
(1)原理
蒸发结晶:蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。例如:当NaCl和KNO3的混合物中NaCl多而KNO3少时,即可采用此法,先分离出NaCl,再分离出KNO3。
可以观察溶解度曲线,溶解度随温度升高而升高得很明显时,这个溶质叫陡升型,反之叫缓升型。
当陡升型溶液中混有缓升型时,若要分离出陡升型,可以用降温结晶的方法分离,若要分离出缓升型的溶质,可以用蒸发结晶的方法,也就是说,蒸发结晶适合溶解度随温度变化不大的物质,如:氯化钠。
如硝酸钾就属于陡升型,氯化钠属于缓升型,所以可以用蒸发结晶来分离出氯化钠,也可以用降温结晶分离出硝酸钾。
(2)实验过程
在蒸发皿中进行,蒸发皿放于铁架台的铁圈上,倒入液体不超过蒸发皿容积的2/3,蒸发过程中不断用玻璃棒搅拌液体,防止受热不均,液体飞溅。看到有大量固体析出,或者仅余少量液体时,停止加热,利用余热将液体蒸干
2、降温结晶
先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出,叫降温结晶。例如:当NaCl和KNO3的混合物中KNO3多而NaCl少时,即可采用此法,先分离出KNO3,再分离出NaCl。
降温结晶后,溶质的质量变小;溶剂的质量不变;溶液的质量变小;溶质质量分数变小;溶液的状态是饱和状态。
(1)原理
①降温结晶的原理是温度降低,物质的溶解度减小,溶液达到饱和了,多余的即不能溶解的溶质就会析出。蒸发结晶的原理是恒温情况下或蒸发前后的温度不变,溶解度不变,水分减少,溶液达到饱和了即多余的溶质就会析出。例如盐碱湖夏天晒盐,冬天捞碱,就是这个道理。
②如果两种可溶物质混合后的分离或提纯,谁多容易达到饱和,就用谁的结晶方法,如氯化钠中含有少量的碳酸钠杂质,就要用到氯化钠的结晶方法即蒸发结晶,反之则用降温结晶。
③当然有关了。溶解度曲线呈明显上升趋势的物质,其溶解度随温度变化较大,一般用降温结晶,溶解度曲线略平的物质,其溶解随温度变化不大,一般用蒸发结晶。
④补充说明:“谁容易达到饱和”就是说两种可溶物质中的哪一种物质的含量较大,那么它就先达到饱和。这时它就容易析出,我们就采用它的结晶方法。
⑤氢氧化钙和气体除外,因为其溶解度曲线为随温度升高而降低,所以采用冷却热饱和溶液时,应降温,其余方法相同。
结晶法分离混合物:
对于几种可溶性固态物质的混合物可根据它们的溶解度受温度影响大小的不同,采用结晶法分离。如分离KNO3和少量NaCl的混合物,可先将它们配制成热饱和溶液,然后再采用冷却热饱和溶液的方法进行分离。

水的结晶
1、物质从液态(溶液或溶融状态)或气态形成晶体的过程。
2、晶体,即原子、离子或分子按一定的空间次序排列而形成的固体。也叫结晶体。
结晶方法:
一般为两种,一种是蒸发结晶,一种是降温结晶。
1、蒸发结晶
(1)原理
蒸发结晶:蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。例如:当NaCl和KNO3的混合物中NaCl多而KNO3少时,即可采用此法,先分离出NaCl,再分离出KNO3。
可以观察溶解度曲线,溶解度随温度升高而升高得很明显时,这个溶质叫陡升型,反之叫缓升型。
当陡升型溶液中混有缓升型时,若要分离出陡升型,可以用降温结晶的方法分离,若要分离出缓升型的溶质,可以用蒸发结晶的方法,也就是说,蒸发结晶适合溶解度随温度变化不大的物质,如:氯化钠。
如硝酸钾就属于陡升型,氯化钠属于缓升型,所以可以用蒸发结晶来分离出氯化钠,也可以用降温结晶分离出硝酸钾。
(2)实验过程
在蒸发皿中进行,蒸发皿放于铁架台的铁圈上,倒入液体不超过蒸发皿容积的2/3,蒸发过程中不断用玻璃棒搅拌液体,防止受热不均,液体飞溅。看到有大量固体析出,或者仅余少量液体时,停止加热,利用余热将液体蒸干
2、降温结晶
先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出,叫降温结晶。例如:当NaCl和KNO3的混合物中KNO3多而NaCl少时,即可采用此法,先分离出KNO3,再分离出NaCl。
降温结晶后,溶质的质量变小;溶剂的质量不变;溶液的质量变小;溶质质量分数变小;溶液的状态是饱和状态。
(1)原理
①降温结晶的原理是温度降低,物质的溶解度减小,溶液达到饱和了,多余的即不能溶解的溶质就会析出。蒸发结晶的原理是恒温情况下或蒸发前后的温度不变,溶解度不变,水分减少,溶液达到饱和了即多余的溶质就会析出。例如盐碱湖夏天晒盐,冬天捞碱,就是这个道理。
②如果两种可溶物质混合后的分离或提纯,谁多容易达到饱和,就用谁的结晶方法,如氯化钠中含有少量的碳酸钠杂质,就要用到氯化钠的结晶方法即蒸发结晶,反之则用降温结晶。
③当然有关了。溶解度曲线呈明显上升趋势的物质,其溶解度随温度变化较大,一般用降温结晶,溶解度曲线略平的物质,其溶解随温度变化不大,一般用蒸发结晶。
④补充说明:“谁容易达到饱和”就是说两种可溶物质中的哪一种物质的含量较大,那么它就先达到饱和。这时它就容易析出,我们就采用它的结晶方法。
⑤氢氧化钙和气体除外,因为其溶解度曲线为随温度升高而降低,所以采用冷却热饱和溶液时,应降温,其余方法相同。
结晶法分离混合物:
对于几种可溶性固态物质的混合物可根据它们的溶解度受温度影响大小的不同,采用结晶法分离。如分离KNO3和少量NaCl的混合物,可先将它们配制成热饱和溶液,然后再采用冷却热饱和溶液的方法进行分离。
定义:
指利用液体混合物中各组分挥发性的差异而将组分分离的传质过程。将液体沸腾产生的蒸气导入冷凝管,使之冷却凝结成液体的一种蒸发、冷凝的过程。
蒸馏是分离沸点相差较大的混合物的一种重要的操作技术,尤其是对于液体混合物的分离有重要的实用意义。
即,蒸馏条件:1.液体是混合物。2.各组分沸点不同。
实验室制蒸馏水:
(1)原理:蒸馏是利用互相溶解的液体混合物中各组分沸点小同进行分离提纯的操作。其过程是:加热样品使其中某组分汽化,然后使蒸气冷凝为液体加以收集。
(2)仪器:铁架台、蒸馏烧瓶、冷凝管、尾接管、锥形瓶、温度计、酒精灯、石棉网等。
(3)装置:
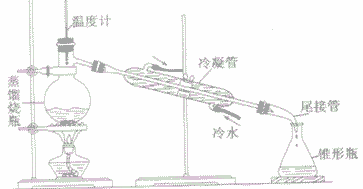
(4)操作:
①用洒精灯外焰给受热仪器先预热后加热
②对蒸馏烧瓶(烧杯、烧瓶、锥形瓶等仪器)加热时,不能直接加热,一定要垫石棉网,蒸馏烧瓶中液体体积为容器容积的1/3—2/3
③温度计不能直接插人蒸馏烧瓶的液体之中,应使温度计水银球与蒸馏烧瓶支管口位于同一水平线上
④蒸馏烧瓶的支管必须露出橡皮塞以防蒸馏出来的液体接触橡皮塞而带入杂质
⑤冷凝管中冷水的走向应是下口进、上口出,以使蒸汽充分冷却。
(5)关键:
①控制好加热温度。如果采用加热浴,加热浴的温度应当比蒸馏液体的沸点高出若干度,否则难以将被蒸馏物蒸馏出来。加热浴温度比蒸馏液体沸点高出的越多,蒸馏速度越快。但是,加热浴的温度也不能过高,否则会导致蒸馏瓶和冷凝器上部的蒸气压超过大气压,有可能产生事故,特别是在蒸馏低沸点物质时尤其需注意。一般地,加热浴的温度不能比蒸馏物质的沸点高出30℃。整个蒸馏过程要随时添加浴液,以保持浴液液面超过瓶中的液面至少一公分。
②蒸馏高沸点物质时,由于易被冷凝,往往蒸气未到达蒸馏烧瓶的侧管处即已经被冷凝而滴回蒸馏瓶中。因此,应选用短颈蒸馏瓶或者采取其它保温措施等,保证蒸馏顺利进行。
③蒸馏之前,必须了解被蒸馏的物质及其杂质的沸点和饱和蒸气压,以决定何时(即在什么温度时)收集馏分。
④蒸馏烧瓶应当采用圆底烧瓶。沸点在40-150℃的液体可采用150℃以上的液体,或沸点虽在150℃以下,对热不稳常压的简单蒸馏。对于沸点在定、易热分解的液体,可以采用减压蒸馏和水蒸汽蒸馏。
(6)简易装置
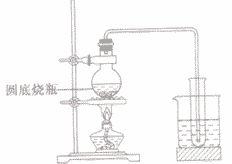
(7)应用
①水的净化
②石油的分馏
(8)蒸馏化学口诀
隔网加热冷管倾,上缘下缘两相平。
需加碎瓷防暴沸,热气冷水逆向行。
瓶中液限掌握好,先撤酒灯水再停。
指利用液体混合物中各组分挥发性的差异而将组分分离的传质过程。将液体沸腾产生的蒸气导入冷凝管,使之冷却凝结成液体的一种蒸发、冷凝的过程。
蒸馏是分离沸点相差较大的混合物的一种重要的操作技术,尤其是对于液体混合物的分离有重要的实用意义。
即,蒸馏条件:1.液体是混合物。2.各组分沸点不同。
实验室制蒸馏水:
(1)原理:蒸馏是利用互相溶解的液体混合物中各组分沸点小同进行分离提纯的操作。其过程是:加热样品使其中某组分汽化,然后使蒸气冷凝为液体加以收集。
(2)仪器:铁架台、蒸馏烧瓶、冷凝管、尾接管、锥形瓶、温度计、酒精灯、石棉网等。
(3)装置:

(4)操作:
①用洒精灯外焰给受热仪器先预热后加热
②对蒸馏烧瓶(烧杯、烧瓶、锥形瓶等仪器)加热时,不能直接加热,一定要垫石棉网,蒸馏烧瓶中液体体积为容器容积的1/3—2/3
③温度计不能直接插人蒸馏烧瓶的液体之中,应使温度计水银球与蒸馏烧瓶支管口位于同一水平线上
④蒸馏烧瓶的支管必须露出橡皮塞以防蒸馏出来的液体接触橡皮塞而带入杂质
⑤冷凝管中冷水的走向应是下口进、上口出,以使蒸汽充分冷却。
(5)关键:
①控制好加热温度。如果采用加热浴,加热浴的温度应当比蒸馏液体的沸点高出若干度,否则难以将被蒸馏物蒸馏出来。加热浴温度比蒸馏液体沸点高出的越多,蒸馏速度越快。但是,加热浴的温度也不能过高,否则会导致蒸馏瓶和冷凝器上部的蒸气压超过大气压,有可能产生事故,特别是在蒸馏低沸点物质时尤其需注意。一般地,加热浴的温度不能比蒸馏物质的沸点高出30℃。整个蒸馏过程要随时添加浴液,以保持浴液液面超过瓶中的液面至少一公分。
②蒸馏高沸点物质时,由于易被冷凝,往往蒸气未到达蒸馏烧瓶的侧管处即已经被冷凝而滴回蒸馏瓶中。因此,应选用短颈蒸馏瓶或者采取其它保温措施等,保证蒸馏顺利进行。
③蒸馏之前,必须了解被蒸馏的物质及其杂质的沸点和饱和蒸气压,以决定何时(即在什么温度时)收集馏分。
④蒸馏烧瓶应当采用圆底烧瓶。沸点在40-150℃的液体可采用150℃以上的液体,或沸点虽在150℃以下,对热不稳常压的简单蒸馏。对于沸点在定、易热分解的液体,可以采用减压蒸馏和水蒸汽蒸馏。
(6)简易装置

(7)应用
①水的净化
②石油的分馏
(8)蒸馏化学口诀
隔网加热冷管倾,上缘下缘两相平。
需加碎瓷防暴沸,热气冷水逆向行。
瓶中液限掌握好,先撤酒灯水再停。
饱和溶液和不饱和溶液的概念:
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液 不饱和溶液
不饱和溶液
(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水 不饱和石灰水
不饱和石灰水
概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)
溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液 饱和溶液
饱和溶液
溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)
溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液 不饱和溶液
不饱和溶液
溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
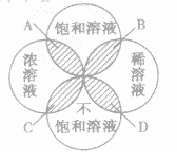 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
①饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,
叫做这种溶质的饱和溶液
②不饱和溶液:在一定温度下,在一定量的溶剂里,还能再继续溶解某种溶质的溶液,
叫做这种溶质的不饱和溶液
饱和溶液与不饱和溶液的相互转化方法:
(1)对于大多数固体:在一定量的水中溶解的最大量随温度升高而增大
饱和溶液
 不饱和溶液
不饱和溶液(2)对于Ca(OH)2:在一定量的水中溶解的最大量随温度升高而减少
饱和石灰水
 不饱和石灰水
不饱和石灰水概念的理解:
(1)溶液的饱和与不饱和跟温度和溶质的量的多少有关系。因此在谈饱和溶液与不饱和溶液时,一定要强调“在一定温度下”和“一定量的溶剂里”,否则就无意义。
(2)一种溶质的饱和溶液仍然可以溶解其他溶质。如氯化钠的饱和溶液中仍可溶解蔗糖。
(3)有些物质能与水以任意比例互溶,不能形成饱和溶液,如:酒精没有饱和溶液。
饱和溶液和不饱和溶液的相互转化:
一般,对饱和溶液与不饱和溶液相互转化过程中溶液组成的分析:
①饱和溶液
 不饱和溶液(或不饱和溶液
不饱和溶液(或不饱和溶液 饱和溶液。不发生结晶的前提下)
饱和溶液。不发生结晶的前提下)溶液中溶质、溶剂、溶液的质量不变,溶质质量分数不变。
②不饱和溶液
 饱和溶液
饱和溶液溶液的溶剂质量不变,溶质、溶液、溶质质量分数均增大。
③不饱和溶液
 饱和溶液(不发生结晶的前提下)
饱和溶液(不发生结晶的前提下)溶质质量不变,溶剂、溶液质量变小,溶质质量分数变大。
④饱和溶液
 不饱和溶液
不饱和溶液溶剂、溶液质量增大,溶质质量不变,溶质质量分数变小
判断溶液是否饱和的方法:
①观察法:当溶液底部有剩余溶质存在,且溶质的量不再减少时,表明溶液已饱和。
②实验法:当溶液底部无剩余溶质存在时,可向该溶液中加入少量该溶质,搅拌后,若能溶解或溶解一部分,表明该溶液不饱和;若不能溶解,则表明该溶液已饱和。
浓溶液,稀溶液与饱和溶液,不饱和溶液的关系:
为粗略地表示溶液中溶质含量的多少,常把溶液分为浓溶液和稀溶液。在一定量的溶液里含溶质的量相对较多的是浓溶液,含溶质的量相对较少的是稀溶液。它们与饱和溶液、不饱和溶液的关系如下图所示:
 A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液
A. 饱和浓溶液B.饱和稀溶液C.不饱和浓溶液D.不饱和稀溶液(1)溶液的饱和与不饱和与溶液的浓和稀没有必然关系。
(2)饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液;浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液。
(3)在一定温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
概念:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)
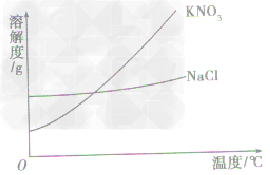
(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里,该温度下的溶解度。
正确理解溶解度概念的要素:
①条件:在一定温度下,影响固体物质溶解度的内因是溶质和溶剂的性质,而外因就是温度。如果温度改变,则固体物质的溶解度也会改变,因此只有指明温度时,溶解度才有意义。
②标准:“在100g溶剂里”,需强调和注意的是:此处100g是溶剂的质量,而不是溶液的质量。
③状态:“达到饱和状态”,溶解度是衡址同一条件下某种物质溶解能力大小的标准,只有达到该条件下溶解的最大值,才可知其溶解度,因此必须要求“达到饱和状态”。
④单位:溶解度是所溶解的质量,常用单位为克(g)。
概念的理解:
①如果不指明溶剂,通常所说的溶解度是指固体物质在水中的溶解度。
②溶解度概念中的四个关键点:“一定温度,100g 溶剂、饱和状态、溶解的质量”是同时存在的,只有四个关键点都体现出来了,溶解度的概念和应用才是有意义的,否则没有意义,说法也是不正确的。
溶解度曲线:
在平面直角坐标系里用横坐标表示温度,纵坐标表示溶解度,画出某物质的溶解度随温度变化的曲线,叫这种物质的溶解度曲线。
①表示意义
a.表示某物质在不同温度下的溶解度和溶解度随温度变化的情况;
b.溶解度曲线上的每一个点表示该溶质在某一温度下的溶解度;
c.两条曲线的交点表示这两种物质在某一相同温度下具有相同的溶解度;
d.曲线下方的点表示溶液是不饱和溶液;
e.在溶解度曲线上方靠近曲线的点表示过饱和溶液(一般物质在较高温度下制成饱和溶液,快速地降到室温,溶液中溶解的溶质的质量超过室温的溶解度,但尚未析出晶体时的溶液叫过饱和溶液)。
②溶解度曲线的变化规律
a.有些固体物质的溶解度受温度影响较大,表现在曲线“坡度”比较“陡”,如KNO3;
b.少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl 。
c.极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2
③应用
a.根据溶解度曲线可以查出某物质在一定温度下的溶解度;
b.可以比较不同物质在同一温度下的溶解度大小;
c.可以知道某物质的溶解度随温度的变化情况;
d.可以选择对混合物进行分离或提纯的方法;
e.确定如何制得某温度时某物质的饱和溶液的方法等。
运用溶解度曲线判断混合物分离、提纯的方法:
根据溶解度曲线受温度变化的影响,通过改变温度或蒸发溶剂,使溶质结晶折出,从而达到混合物分离、提纯的目的。如KNO3和NaCl的混合物的分离。 (KNO3,NaCl溶解度曲线如图)

(1)温度变化对物质溶解度影响较大,要提纯这类物质。可采用降温结晶法。
具体的步骤为:①配制高温时的饱和溶液,②降温,③过滤,④干燥。如KNO3中混有少量的NaCl,提纯KNO3可用此法。
(2)温度变化对物质溶解度影响较小,要提纯这类物质,可用蒸发溶剂法。
具体步骤为:①溶解,②蒸发溶剂,③趁热过滤,④干燥。如NaCl中混有少量KNO3,要提纯NaCl,可配制溶液,然后蒸发溶剂,NaCl结晶析出,而KNO3在较高温度下,还没有达到饱和,不会结晶,趁热过滤,可得到较纯净的NaCl。
发现相似题
与“如图为晶体M(不含结晶水)的溶解度曲线,a、b两点分别表示M...”考查相似的试题有:
- 下图的实验操作中正确的是( )A. 闻气体气味B. 移走蒸发皿C. 倾倒液体D. 稀释浓硫酸
- 下图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题.(1)t1℃时,100g水中溶解20g甲,溶液刚好饱和;那么,50g水中...
- 下列操作能将食盐水转化为纯净水的是( )A.过滤B.沉淀C.蒸馏D.吸附
- 通常情况下,欲将一杯不饱和的食盐水变成饱和溶液,最适宜的方法是[ ]A、往食盐水中加食盐B、往食盐水中加水C、往食盐水中加...
- 下列有关溶液及溶解度的说法正确的是( )A.同一种溶质的水溶液,饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量...
- 溶液在工农业生产和人们的日常生活中有着极其广泛的用途.下列有关溶液的叙述中正确的是( )A.均一、稳定、无色、透明的液...
- 在一定温度下,为使溶质是固体物质的不饱和溶液变成饱和溶液,可采取的办法是( )A.增大压强B.升高温度C.加入溶质D.增加...
- 氯化钠和碳酸钠晶体的溶解度(0℃~30℃)如表所示,根据表中数据分析,下列说法错误的是[ ]A.碳酸钠晶体的溶解度受温度的影响...
- 根据如图回答下列问题:(1)在40℃时,溶解度较大的物质是______,图中交点P表示______.(2)在50℃时,将硝酸钾不饱和溶液转...
- 请你用学到的化学知识解决下列化学问题.(1)一氧化碳和二氧化碳化学性质不同的原因是 ______;(2)厨房中防止菜刀生锈的方...