本试题 “下列说法中,正确的是( )A.浓盐酸和浓硫酸露置在空气中,溶质的质量分数都会减小B.用蒸馏水润湿的pH试纸来测定10%的盐酸溶液的pH,结果偏小C.有盐参加和...” 主要考查您对一氧化碳还原氧化铁
复分解反应
酸碱指示剂
物质的变质
物质的保存
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 一氧化碳还原氧化铁
- 复分解反应
- 酸碱指示剂
- 物质的变质
- 物质的保存
氧化铁自身具有氧化性,我们可以用一氧化碳还原氧化铁。
灼热的氧化铁可以和氢气(H2)、碳(C)、一氧化碳(CO)等具有还原性物质反应,生成铁+X(氧化物)。
实验室一氧化碳还原氧化铁:
①反应原理:3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 ②装置:
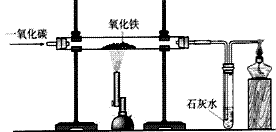
③现象:红色粉末逐渐变为黑色;澄清石灰石变浑浊,尾气燃烧时产生蓝色火焰。
④实验步骤:
a.检验装置的气密性
b.装入药品并固定装置
c.通入一氧化碳气体并点燃酒精灯
d.待装置内的空气全部排尽后点燃酒精喷灯给氧化铁加热
e.当试管内的红色粉末变为黑色时,停止加热
f.待玻璃管内的固体冷却后,停止通一氧化碳,并熄灭酒精灯
⑤实验结论:红色的氧化铁被一氧化碳还原成单质铁,一氧化碳在高温条件下得到了氧,生成了二氧化碳。
⑥化学反应方程式:
3CO + Fe2O3
 2Fe + 3CO2
2Fe + 3CO2 CO2+Ca(OH)2==CaCO3↓+H2O
2CO+O2
 2CO2
2CO2⑦注意事项:
a.反应条件:高温;若无洒粉喷灯可在酒精灯火焰上加一个金属网罩。
b.CO有剧毒,实验应在通风橱中进行,未反应完的气体要进行尾气处理;尾气处理方法有收集法、燃烧法(将CO转变为无毒的CO2)以防止污染空气。
c.操作顺序:CO要“早出晚归”,洒精喷灯要“迟到早退”。
实验开始先通入CO,排尽装置内的空气,防止CO 与空气混合,加热时发生爆炸;实验完毕后要继续通入 CO气体,直到玻璃管冷却,防止高温下的铁与空气接触,被氧化。
复分解反应:
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
(1)概念:两种化合物互相交换成分,生成另外两种化合物的反应,形如AB+CD==AD+CB
(2)特点:
①一般在水溶液里进行,两种化合物中的离子互换。
②元素的化合价不改变。
(3)复分解反应的实质:复分解反应从微观角度看,是反应物之间相互交换离子,阴、阳离子重新结合生成沉淀或气体或水。如酸与碱发生中和反应的实质为:H++OH-==H2O。
复分解反应发生的条件:
| 规律 | 发生的条件 |
| 金属氧化物+酸 | 生成物中有水,一般都能反应 |
| 酸+碱→盐+水 | 中和反应,有水生成,一般都能反应 |
| 酸+盐→新酸+新盐 | 生成物种有沉淀,气体或水 |
| 碱+盐→新碱+新盐 | 生成物种有沉淀,气体或水 |
| 盐1+盐2→新盐1+新盐2 | 生成物种有沉淀 |
常见的复分解反应:
①常见的有沉淀生成的复分解反应
Na2CO3+Ca(OH)2=CaCO3+2NaOH
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
NaCl+AgNO3==AgCl↓+NaNO3
H2SO4+BaCl2==BaSO4↓+2HCl
②常见的有气休生成的复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑
2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O
③常见的有水生成的复分解反应
NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+H2O+CO2↑
易错点:
例如CO2+Ca(OH)2====CaCO3↓+H2O这样的反应不是复分解反应。因为,根据复分解反应的定义。只有两种化合物互相交换成分,生成两种新的化合物的反应才是复分解反应。如:H2SO4+BaCl2====BaSO4↓+2HCl这个反应中,硫酸的成分(氢离子和硫酸根离子)与氯化钡的成分(氯离子和钡离子)互相交换,形成了硫酸钡和盐酸。而CO2+Ca(OH)2==CaCO3↓+H2O反应中二氧化碳的成分(C和O2)并没有与氢氧化钙的成分(钙离子和氢氧根离子)互相交换,所以这样的反应不是复分解反应。同理,CO2+2NaOH==Na2CO3+H2O和SO2+2NaOH===Na2SO3+H2O之类的反应也不是复分解反应。
酸碱指示剂:
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
易错点:
①变色的是指示剂,而不是酸或碱的溶液。如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。这些植物色素可以用作石蕊和酚酞等指示剂的代用品。一些植物的色素及其在酸碱性溶液中的颜色变化如下:
跟酸或碱的溶液起作用而显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
紫色石蕊试液和无色酚酞试液的显色:
紫色石蕊试液和无色酚酞试液是两种常用的酸碱指示剂,它们与酸性、碱性溶液作用时显示的颜色见下表:
| 酸性溶液 | 碱性溶液 | 中性溶液 | |
| 石蕊试液 | 红 | 蓝 | 紫 |
| 酚酞试液 | 无 | 红 | 无 |
易错点:
①变色的是指示剂,而不是酸或碱的溶液。如盐酸使紫色石蕊试液变红,不能说成紫色石蕊试液使盐酸变红,但可以说紫色石蕊试液遇盐酸变红。
②酸或碱的溶液能使紫色石蕊试液或酚酞试液变色,但能使紫色石蕊试液或酚酞试液变色的不一定是酸或碱的溶液,还可能是酸性盐溶掖或碱性盐溶液。如碳酸钠溶液能使紫色石蕊试液变蓝,但碳酸钠不是碱,而是盐。
酸碱指示剂的代用品:
在自然界里,有许多植物色素在不同的酸碱性溶液中.都会发生特定的颜色变化。这些植物色素可以用作石蕊和酚酞等指示剂的代用品。一些植物的色素及其在酸碱性溶液中的颜色变化如下:
| 代用指示剂的颜色 | |||
| 在酸性溶液中 | 在中性溶液中 | 在碱性溶液中 | |
| 牵牛花 | 红色 | 紫色 | 蓝色 |
| 苏木 | 黄色 | 红棕色 | 玫瑰红色 |
| 紫萝卜皮 | 红色 | 紫色 | 黄绿色 |
| 月季花 | 浅红色 | 红色 | 黄色 |
| 美人蕉 | 淡红色 | 红色 | 绿色 |
易变质的物质:
1. 由于吸水质量增加的物质:氢氧化钠固体,浓硫酸
2. 由于跟水反应质量增加的物质:氧化钙,氧化钠,硫酸铜
3. 由于和二氧化碳反应质量增加的物质:氢氧化钠,氢氧化钾,氢氧化钙
4. 由于挥发质量减少的物质:浓盐酸,浓硝酸,酒精,氨水
5. 由于风化质量减少的物质:碳酸钠晶体
氢氧化钠变质的知识归纳:
氢氧化钠变质主要考点包括:变质原因、检验变质的方法、检验变质的程度、 除去杂质得到就纯净的氢氧化钠。
1 、氢氧化钠变质的原因:
敞口放置, 与空气中的二氧化碳反应, 生成了碳酸钠。 2NaOH+CO 2 =Na 2 CO 3 +H 2 O
2 、检验氢氧化钠是否变质的方法: ( 分别滴加酸、碱、盐溶液,各为一种方法 )
①取少量样品于试管中, 滴加稀盐酸 ( 或者稀硫酸 ) , 如果产生气泡, 说明已变质。 Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2 ↑
②取少量样品于试管中,滴加氢氧化钙溶液 ( 或者氢氧化钡溶液 ) ,如果产生白色 沉淀,说明已变质。 Na 2 CO 3 +Ca(OH) 2 =CaCO 3 ↓ +2NaOH
③取少量样品于试管中,滴加氯化钙溶液 ( 或者硝酸钙等其它可溶性钙盐、钡盐 溶液 ) Na 2 CO 3 +CaCl 2 =CaCO 3 ↓ +2NaCl
3 、检验氢氧化钠变质程度的方法:
取少量样品于试管中,滴加足量的 CaCl2 溶液,有白色沉淀生成;静置,像上层澄清液中滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
解释:碳酸钠溶液呈碱性,它的存在会影响到氢氧化钠的检验,所以在检验氢氧化钠前必须把碳酸钠除去。除去碳酸钠时不能用酸,因为酸会与氢氧化钠反应; 不能用碱,因为碱会与碳酸钠反应生成氢氧化钠,干扰原来氢氧化钠的检验。
4 、如何除去部分变质的氢氧化钠中的碳酸钠。 滴加适量氢氧化钙溶液至刚好无沉淀生成为止,然后过滤,就得到氢氧化钠溶液,再蒸发,就得到氢氧化钠固体。 Na 2 CO 3 +Ca(OH) 2 =CaCO 3 ↓ +2NaOH
除杂方法:除杂时为了不引入新杂质,如果除去阴离子,所选择试剂的阴离子 与主题物质一致。
氧化钙和氢氧化钙的变质:
(1)变质的原因
氧化钙在空气中敞口放置会与空气中的水蒸气反应生成氢氧化钙 CaO+H 2 O===Ca(OH) 2 , 氢氧化钙继续与空气中的二氧化碳反应生成碳酸钙。 Ca(OH) 2 +CO 2 ====CaCO 3 ↓+H 2 O
(2)检验变质后物质存在的方法:
氧化钙:
取少量变质后的固体放入烧杯中,加入水充分溶解,用手摸烧杯外壁有灼热感。
氢氧化钙:
(1)取变质后物质溶于水,向其中通入二氧化碳气体,有白色沉淀生成。
(2)取变质后物质溶于水,向其中滴加碳酸钠溶液,有白色沉淀生成。 碳酸钙:取少量变质后固体,向其中滴加稀盐酸,有气泡冒出。 CaCO3 +2HCl===CaCl2 +H2O+CO2 ↑
【特殊强调】:有氧化钙存在的情况下,初中阶段检验不出氢氧化钙的存在。因为氧化钙溶于水后会生成氢氧化钙,会干扰原来氢氧化钙的检验。
其它常见物质变质的知识小结:
NaOH在空气中变质:2NaOH+CO2==Na2CO3+H2O
检验: 取样滴加稀 HCl,若有气泡产生,则已经变质 (Na 2 CO 3 +2HCl===2NaCl+H 2 O+CO 2 ↑ )
消石灰 [Ca(OH)2] 放在空气中变质: Ca(OH) 2 +CO 2 ====CaCO 3 ↓ +H 2 O
检验: 取样滴加稀 HCl,若有气泡产生,则已经变质 (CaCO 3 +2HCl===CaCl 2 +H 2 O+CO 2 ↑ )
生石灰 (CaO) 暴露在空气中变质: CaO+H 2 O===Ca(OH) 2
检验: 取样用试管加热,若试管内壁有小水珠产生,则已变质 [Ca(OH) 2 = 加热 =CaO+H 2 O]
铁生锈:4Fe+3O 2 ===2Fe2O3
检验:观察颜色 , 若有红色粉末在表面, 则已变质
铜生锈:2Cu+O 2 +CO 2 +H 2 O===Cu 2 (OH) 2 CO 3
检验:观察颜色 , 若有绿色粉末在表面,则已变质。
1. 由于吸水质量增加的物质:氢氧化钠固体,浓硫酸
2. 由于跟水反应质量增加的物质:氧化钙,氧化钠,硫酸铜
3. 由于和二氧化碳反应质量增加的物质:氢氧化钠,氢氧化钾,氢氧化钙
4. 由于挥发质量减少的物质:浓盐酸,浓硝酸,酒精,氨水
5. 由于风化质量减少的物质:碳酸钠晶体
氢氧化钠变质的知识归纳:
氢氧化钠变质主要考点包括:变质原因、检验变质的方法、检验变质的程度、 除去杂质得到就纯净的氢氧化钠。
1 、氢氧化钠变质的原因:
敞口放置, 与空气中的二氧化碳反应, 生成了碳酸钠。 2NaOH+CO 2 =Na 2 CO 3 +H 2 O
2 、检验氢氧化钠是否变质的方法: ( 分别滴加酸、碱、盐溶液,各为一种方法 )
①取少量样品于试管中, 滴加稀盐酸 ( 或者稀硫酸 ) , 如果产生气泡, 说明已变质。 Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2 ↑
②取少量样品于试管中,滴加氢氧化钙溶液 ( 或者氢氧化钡溶液 ) ,如果产生白色 沉淀,说明已变质。 Na 2 CO 3 +Ca(OH) 2 =CaCO 3 ↓ +2NaOH
③取少量样品于试管中,滴加氯化钙溶液 ( 或者硝酸钙等其它可溶性钙盐、钡盐 溶液 ) Na 2 CO 3 +CaCl 2 =CaCO 3 ↓ +2NaCl
3 、检验氢氧化钠变质程度的方法:
取少量样品于试管中,滴加足量的 CaCl2 溶液,有白色沉淀生成;静置,像上层澄清液中滴加少量酚酞溶液,如果溶液变红色,说明溶液部分变质;如果溶液呈无色,说明氢氧化钠完全变质。
解释:碳酸钠溶液呈碱性,它的存在会影响到氢氧化钠的检验,所以在检验氢氧化钠前必须把碳酸钠除去。除去碳酸钠时不能用酸,因为酸会与氢氧化钠反应; 不能用碱,因为碱会与碳酸钠反应生成氢氧化钠,干扰原来氢氧化钠的检验。
4 、如何除去部分变质的氢氧化钠中的碳酸钠。 滴加适量氢氧化钙溶液至刚好无沉淀生成为止,然后过滤,就得到氢氧化钠溶液,再蒸发,就得到氢氧化钠固体。 Na 2 CO 3 +Ca(OH) 2 =CaCO 3 ↓ +2NaOH
除杂方法:除杂时为了不引入新杂质,如果除去阴离子,所选择试剂的阴离子 与主题物质一致。
氧化钙和氢氧化钙的变质:
(1)变质的原因
氧化钙在空气中敞口放置会与空气中的水蒸气反应生成氢氧化钙 CaO+H 2 O===Ca(OH) 2 , 氢氧化钙继续与空气中的二氧化碳反应生成碳酸钙。 Ca(OH) 2 +CO 2 ====CaCO 3 ↓+H 2 O
(2)检验变质后物质存在的方法:
氧化钙:
取少量变质后的固体放入烧杯中,加入水充分溶解,用手摸烧杯外壁有灼热感。
氢氧化钙:
(1)取变质后物质溶于水,向其中通入二氧化碳气体,有白色沉淀生成。
(2)取变质后物质溶于水,向其中滴加碳酸钠溶液,有白色沉淀生成。 碳酸钙:取少量变质后固体,向其中滴加稀盐酸,有气泡冒出。 CaCO3 +2HCl===CaCl2 +H2O+CO2 ↑
【特殊强调】:有氧化钙存在的情况下,初中阶段检验不出氢氧化钙的存在。因为氧化钙溶于水后会生成氢氧化钙,会干扰原来氢氧化钙的检验。
其它常见物质变质的知识小结:
NaOH在空气中变质:2NaOH+CO2==Na2CO3+H2O
检验: 取样滴加稀 HCl,若有气泡产生,则已经变质 (Na 2 CO 3 +2HCl===2NaCl+H 2 O+CO 2 ↑ )
消石灰 [Ca(OH)2] 放在空气中变质: Ca(OH) 2 +CO 2 ====CaCO 3 ↓ +H 2 O
检验: 取样滴加稀 HCl,若有气泡产生,则已经变质 (CaCO 3 +2HCl===CaCl 2 +H 2 O+CO 2 ↑ )
生石灰 (CaO) 暴露在空气中变质: CaO+H 2 O===Ca(OH) 2
检验: 取样用试管加热,若试管内壁有小水珠产生,则已变质 [Ca(OH) 2 = 加热 =CaO+H 2 O]
铁生锈:4Fe+3O 2 ===2Fe2O3
检验:观察颜色 , 若有红色粉末在表面, 则已变质
铜生锈:2Cu+O 2 +CO 2 +H 2 O===Cu 2 (OH) 2 CO 3
检验:观察颜色 , 若有绿色粉末在表面,则已变质。
初中化学中常见物质的保存:
1.钠保存在煤油中
2.NaOH溶液用橡胶塞
3.硝酸用玻璃塞棕色瓶
4.硝酸银用棕色瓶
5.白磷保存在水中
物质保存中需注意:
一、 防挥发:
1 .油封:氨水,浓盐酸,浓硝酸等易挥发无机液体,在液面上滴 10 ~ 20 滴矿物油,可以 防止挥发(不可用植物油)。
2 .水封:二硫化碳中加 5mL 水,便可长期保存。汞上加水,可防汞蒸气进入空气。汞旁放 些硫粉,一但失落,散布硫粉使遗汞消灭于化学反应中。
3 .腊封:乙醚、乙醇、甲酸等比水轻的或易溶性挥发液体,以及萘、碘等易挥发固体,紧 密瓶塞,瓶口涂腊。 溴除进行原瓶腊封外,应将原瓶置于具有活性炭的塑料筒内, 筒口进行 腊封。
二、防潮:
1 .漂白粉、过氧化钠应该进行腊封,防止吸水分解或吸水爆炸。氢氧化钠易吸水潮解,应 该进行腊封; 硝酸铵、 硫酸钠易吸水结状, 倒不出来, 以至导致试剂瓶破裂, 也应严密腊封。
2 .碳化钙、无水硫酸铜、五氧化二磷、硅胶极易吸水变质,红磷易被氧化,然后吸水生成 偏磷酸,以上各物均应存放在干燥器中。
3 .浓硫酸虽应密闭,防止吸水,但因常用,故宜放磨口瓶中,磨口瓶塞应该原配,切勿对调。
4 .“ 特殊药品 ” 的地下室,下层布块灰,中层布熟石灰上层布双层柏油纸,方可存放药物。
三、防变质:
1 .防氧化:亚硫酸钠、硫酸亚铁、硫代硫酸钠均易被氧化,瓶口应涂腊。
2 .防碳酸化:硅酸钠、过氧化钠、苛性碱均易吸收二氧化碳,应该涂腊。
3 .防风化:晶体碳酸钠、晶体硫酸铜应进行腊封,存放在地下室中。
4 .防分解:碳酸氢铵、浓硝酸受热易分解,涂腊后,存放在地下室中。
5 .活性炭能吸附多种气体而变质,(木炭亦同),应放在干燥器中。
6 .黄磷遇空气易自燃,永远保存水中,每 15 天查水一次:磷试剂瓶中加水、置于有水水 糟中,上加钟罩封闭。
7 .钾、钠保存在火油中。
8.硫酸亚铁溶液中滴几滴稀硫酸,加入过量细铁粉,进行腊封。
9 .葡萄糖溶液容易霉变,稍加几滴甲醛即可保存。
10 .甲醛易聚合,应开瓶后立即加少量甲醇;乙醛则加乙醇。
四、防光:
1 .硝酸银,浓硝酸及大部份有机药品应该放在棕色瓶中。
2 .硝酸盐存放在地下室中既防热,又防光、防火还能防震。
3 .有机试剂橱窗一律用黑漆涂染。
4 .实验室用色布窗帘,内红外黑双层。
五、防毒害:
1 .磷、硝酸银、氯酸钾、氯化汞等剧毒物放地下室内,双人双锁,建立档案,呈批取用, 使用记载,定期检查。
2 .磷化钙、磷化铝吸水后放出剧毒性磷化氢,应放在干燥器中保存,贴上红色标签。
3 .由于没有通风橱,经常在地面布石灰,吸附某些毒害气相物质。
4 .浓酸,浓碱、溴、酚等腐蚀的药物,使用红色标签,以示警戒。
六、防震:
1 .硝酸铵震动易爆炸,放地下室中。
2 .自制的大晶体明矾、大晶体硫酸铜,用软纸垫包放大口试剂瓶中,进行缓冲,并按 “ 四位 数字 ” 进行编号入厨。
1.钠保存在煤油中
2.NaOH溶液用橡胶塞
3.硝酸用玻璃塞棕色瓶
4.硝酸银用棕色瓶
5.白磷保存在水中
物质保存中需注意:
一、 防挥发:
1 .油封:氨水,浓盐酸,浓硝酸等易挥发无机液体,在液面上滴 10 ~ 20 滴矿物油,可以 防止挥发(不可用植物油)。
2 .水封:二硫化碳中加 5mL 水,便可长期保存。汞上加水,可防汞蒸气进入空气。汞旁放 些硫粉,一但失落,散布硫粉使遗汞消灭于化学反应中。
3 .腊封:乙醚、乙醇、甲酸等比水轻的或易溶性挥发液体,以及萘、碘等易挥发固体,紧 密瓶塞,瓶口涂腊。 溴除进行原瓶腊封外,应将原瓶置于具有活性炭的塑料筒内, 筒口进行 腊封。
二、防潮:
1 .漂白粉、过氧化钠应该进行腊封,防止吸水分解或吸水爆炸。氢氧化钠易吸水潮解,应 该进行腊封; 硝酸铵、 硫酸钠易吸水结状, 倒不出来, 以至导致试剂瓶破裂, 也应严密腊封。
2 .碳化钙、无水硫酸铜、五氧化二磷、硅胶极易吸水变质,红磷易被氧化,然后吸水生成 偏磷酸,以上各物均应存放在干燥器中。
3 .浓硫酸虽应密闭,防止吸水,但因常用,故宜放磨口瓶中,磨口瓶塞应该原配,切勿对调。
4 .“ 特殊药品 ” 的地下室,下层布块灰,中层布熟石灰上层布双层柏油纸,方可存放药物。
三、防变质:
1 .防氧化:亚硫酸钠、硫酸亚铁、硫代硫酸钠均易被氧化,瓶口应涂腊。
2 .防碳酸化:硅酸钠、过氧化钠、苛性碱均易吸收二氧化碳,应该涂腊。
3 .防风化:晶体碳酸钠、晶体硫酸铜应进行腊封,存放在地下室中。
4 .防分解:碳酸氢铵、浓硝酸受热易分解,涂腊后,存放在地下室中。
5 .活性炭能吸附多种气体而变质,(木炭亦同),应放在干燥器中。
6 .黄磷遇空气易自燃,永远保存水中,每 15 天查水一次:磷试剂瓶中加水、置于有水水 糟中,上加钟罩封闭。
7 .钾、钠保存在火油中。
8.硫酸亚铁溶液中滴几滴稀硫酸,加入过量细铁粉,进行腊封。
9 .葡萄糖溶液容易霉变,稍加几滴甲醛即可保存。
10 .甲醛易聚合,应开瓶后立即加少量甲醇;乙醛则加乙醇。
四、防光:
1 .硝酸银,浓硝酸及大部份有机药品应该放在棕色瓶中。
2 .硝酸盐存放在地下室中既防热,又防光、防火还能防震。
3 .有机试剂橱窗一律用黑漆涂染。
4 .实验室用色布窗帘,内红外黑双层。
五、防毒害:
1 .磷、硝酸银、氯酸钾、氯化汞等剧毒物放地下室内,双人双锁,建立档案,呈批取用, 使用记载,定期检查。
2 .磷化钙、磷化铝吸水后放出剧毒性磷化氢,应放在干燥器中保存,贴上红色标签。
3 .由于没有通风橱,经常在地面布石灰,吸附某些毒害气相物质。
4 .浓酸,浓碱、溴、酚等腐蚀的药物,使用红色标签,以示警戒。
六、防震:
1 .硝酸铵震动易爆炸,放地下室中。
2 .自制的大晶体明矾、大晶体硫酸铜,用软纸垫包放大口试剂瓶中,进行缓冲,并按 “ 四位 数字 ” 进行编号入厨。
发现相似题
与“下列说法中,正确的是( )A.浓盐酸和浓硫酸露置在空气中,...”考查相似的试题有:
- 下列叙述错误的是[ ]A.实验室制取气体时,先检查装置气密性,再装药品B.用托盘天平称量药品时,先使天平平衡,再称量C.用C...
- 饮水安全、环境与能源等问题,已成为当今世界关注的热点和焦点。(1)芦山地震后,为了保证饮水安全,测定水样的pH略小于7,...
- 稀盐酸可以使紫色石蕊试液变红.我们已经知道,在稀盐酸中存在H2O分子、Cl-离子和H+离子.请你设计一个简单实验研究下面的问...
- 在滴有紫色石蕊试液的氢氧化钠溶液里慢慢滴加稀盐酸至过量,溶液的( )A.颜色由蓝色变成红色B.颜色由红色变成蓝色C.颜色...
- 元旦晚会上,小东在表演节目:在一张白纸上喷上碘酒,“空白”的纸出现了“新年快乐”四个蓝色大字。原来小东是根据淀粉溶液遇到...
- 三聚氰胺是一种有毒化工产品,化学式为C3N6H6,摄入含三聚氰胺的奶粉会引起肾结石等疾病,三聚氰胺由______种元素组成,三聚...
- 家中用的食醋可使紫色石蕊试液变成( )A.蓝色B.无色C.紫色D.红色
- 请你阅读一篇来自广东电视台《今日关注》的采访报道,回答有关问题:…这里原来有一条清澈的小河,2004年被规划为工业区,相继...
- 下列叙述正确的是( )A.为了节约药品,实验结束后将剩余药品倒回试剂瓶B.发光放热的变化一定是化学变化C.检查装置气密性...
- 根据所学化学知识判断,下列说法缺乏科学依据的是[ ]A.盛放酒精、浓氨水的瓶子要塞紧瓶塞B.可用汽油洗涤衣服上的油污C.可...