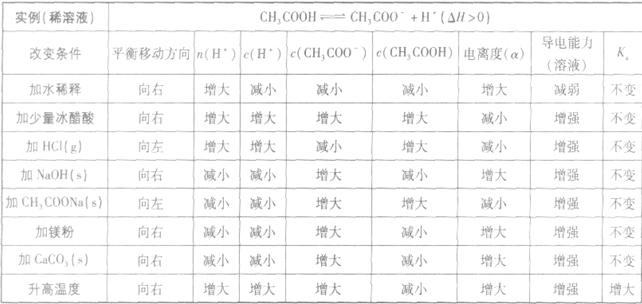
电离平衡的影响因素:
(1)温度:由于弱电解质的电离是吸热过程,故升高温度,将使弱电解质的电离平衡向电离方向移动。
(2)浓度:对于同一弱电解质来说,浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大。因此,加水稀释溶液会使弱电解质的电离平衡向电离的方向移动,电离程度增大,电离出的离子的总量增加,但离子浓度是减小的。
(3)同离子效应:加入与弱电解质具有相同的离子的强电解质则抑制弱电解质的电离。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质,可促进弱电解质的电离。
以醋酸归纳为例:
电离度:
溶液中已电离的分子数占弱电解质分子总数的百分比称为电离度。
定义:
在一定温度、浓度的条件下,弱电解质在溶液中电离成离子的速率与离子结合成分子的速率相等时,电离过程就到了电离平衡状态,叫弱电解质的电离平衡。
 电离平衡的特征:
电离平衡的特征:
(1)等:

(2)动:
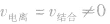
的动态平衡
(3)定:条件一定,分子与离子浓度一定。
(4)变:条件改变,平衡破坏,发生移动。