本试题 “(三选一)【化学与技术】工业上制取硝酸铵的流程图如下,请回答下列问题(1)在上述工业制硝酸的生产中,B设备的名称是_________,其中发生反应的化学方程式...” 主要考查您对铵盐
合成氨(人工固氮)
工业制取硝酸
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 铵盐
- 合成氨(人工固氮)
- 工业制取硝酸
定义:
铵盐是由铵根离子(NH4+)和酸根离子组成的化合物。铵盐都是晶体,都易溶于水。
铵盐的物理性质和化学性质:
(1)物理性质:铵盐是由铵离子(NH4+)和酸根阴离子组成的化合物,铵盐都是白色晶体,都易溶于水。
(2)铵盐的化学性质:
①受热分解:固态铵盐受热都易分解,根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:
A. 组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。例如:
 (试管上端又有白色固体附着)。
(试管上端又有白色固体附着)。又如:
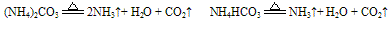
B. 组成铵盐的酸根阴离子对应的酸是难挥发性酸,加热时则只有氨气逸出,酸或酸式盐仍残留在容器中。如:
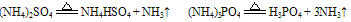
C. 组成铵盐的酸根阴离子对应的酸是氧化性酸,加热时则发生氧化还原反应,无氨气逸出。例如:
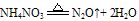
②跟碱反应--铵盐的通性。
固态铵盐+强碱(NaOH、KOH)
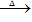 无色、有刺激性气味的气体
无色、有刺激性气味的气体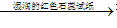 试纸变蓝色。例如:
试纸变蓝色。例如: 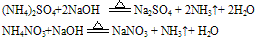
说明:a.若是铵盐溶液与烧碱溶液共热,则可用离子方程式表示为:

b.若反应物为稀溶液且不加热时,则无氨气逸出,用离子方程式表示为:
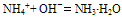
c.若反应物都是固体时,则只能用化学方程式表示。
(3)氮肥的存放和施用.铵盐可用作氮肥.由于铵盐受热易分解,因此在贮存时应密封包装并存放在阴凉通风处;施用氮肥时应埋在土下并及时灌水,以保证肥效。
1.定义:氮的固定是指将游离态的氮转化为化合态氮的方法。
2.方法:氮的固定主要方法有:
(1)人工合成氨 :化学固氨法。其条件要求高、成本高、转化率低、效率低。
(2)根瘤菌,生物固氨。常温常压下进行。成本低、转化率高、效率高。
3.工业应用:模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并创造崭新的化学工艺过程。 二、合成氨的反应原理
1.加热试管中的铁丝绒至红热后注入氢气和氨气的混合气体,可以看到湿润的PH试纸变蓝色
2.用氢 气和氨气合成氨的反应式是
N2+3H2
 2NH3,属放热反应。
2NH3,属放热反应。 3.工业上,采用以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件下合成氨。
(1)催化剂的主要作用:成千上万倍地加快化学反应速率,缩短达平衡的时间,提高日产量。
(2)合成氨的适宜条件:以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件
(3)选择适宜生产条件的原则:有较高的反应速率和平衡转化率,能最大限度地提高利润。
(4)合成氨生产时,不采用尽可能高的压强,通常采用10MPa~30MPa 的压强,否则会增大设备的动力要求,增大成本。
(5)合成氨的反应为放热反应,降低温度促使平衡向有移动,有利于N2、H2转化为NH3;但降温必然减缓了反应速率,影响单位时间产率。生产中将二者综合考虑,既要保证N2、H2的转化率,又要保证较快的反应速率,只能选择适中的温度400~500℃左右。应注意该温度为催化剂活化温度,低于此温度,催化剂不起作用。
(6)催化剂是影响反应速率的几个因素中,对反应速率影响程度最大的。
催化剂的特点:
①选择性:不 同的反应选择不同的催化剂,如合成氨选择了铁触媒。每种催化剂都是对特定的反应有催化作用,并非能改变任何化学反应的速率。
②灵敏性:催化剂中混入杂质,常常会失去催化作 用,称催化剂“中毒”,因此 反应气体进入反应器前必须净化。 ③催化剂只有在活化温度以上才能起催化作用,如铁触媒活化温度为400~500℃,因此该温度为合成氨的适宜温度。
人工固氮技术——合成氨:
1.生产原理
2.合成氨的基本生产过程
(1)原料气的制备要实现合成氨的工业化生产,首先要解决氢气和氮气的来源问题。
①氮气的制备合成氨所需要的氮气都取自空气。从空气中制取氮气通常有两种方法:一是将空气液化后蒸发分离出氧气而获得氮气;二是将空气中的氧气与碳作用生成二氧化碳,再除去二氧化碳得到氮气。
②氢气的制备氢气主要来源于水和碳氢化合物。氢气的制取有下表中的几条途径。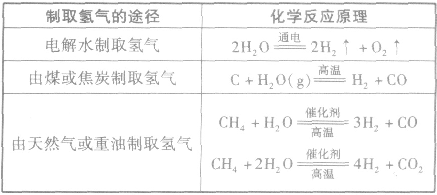
(2)原料气的净化
原料气的净化就是除去原料气中的杂质。在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨所用的催化剂“中毒”(所谓“中毒”即是催化剂失去催化活性),所以必须除去。原料气净化的主要目的是防止催化剂“中毒”。
(3)氨的合成与分离
①氨的合成工业合成氨的主要设备是合成塔。将净化后的原料气经过压缩机压缩后输人合成塔,经过下列化学反应合成氨: 
②氨的分离从合成塔出来的混合气体,通常约含15%(体积分数)的氨。为了使氨从未反应的氮气和氢气里分离出来,要把混合气体通过冷凝器使氨液化,然后在气体分离器里把液态氨分离出来导入液氨贮罐。南气体分离器出来的气体,经过循环压缩机,再送到合成塔中进行反应。
3.合成氨适宜条件的选择
外加条件要尽可能加快反应速率,提高反应物的转化率.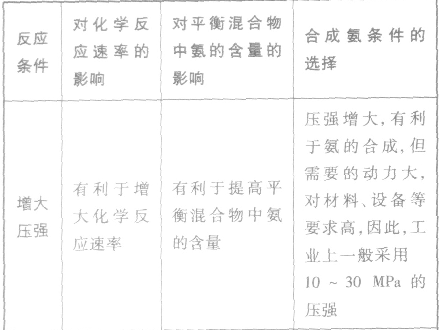
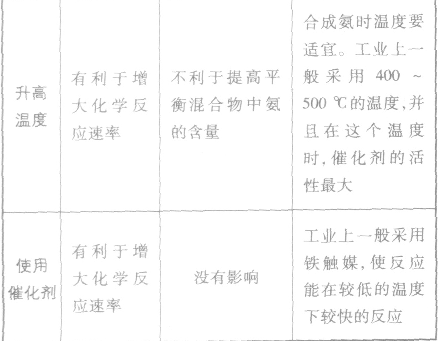
4.合成氨的环境保护
随着环境保护意识的增强,以及相关的法律、法规的严格实施,合成氨生产中可能产生的“三废”的处理越来越成为技术改造的重要问题。
(1)废渣
主要来自造气阶段,特别是以煤为原料而产生的煤渣,用重油为原料产生的炭黑等,现在大都将它们用作建材和肥料的原料。
(2)废气
主要是H2S和CO2等气体。对H2S气体的处理,先后采用了直接氧化法(选择性催化氧化)、循环法(使用溶剂将其吸收浓缩)等回收技术。对CO2 的处理,正在不断研究和改进将其作为尿素和碳铵生产原料的途径。
(3)废液
主要是含氰化物和含氨的污水。目前,处理含氰化物污水主要有生化、加压水解、氧化分解、化学沉淀、反吹回炉等方法;处理含氨废水多以蒸馏的方法回收氨达到综合利用的目的,对浓度过低的含氨废水,可用离子交换法治理。
(1)其法以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于800℃进行氧化反应,生成的NO在冷却时与O2生NO2,NO2在吸收塔内用水吸收在过量空气中O2的作用下转化为硝酸,最高浓度可达50%。
4NH3+5O2
 4NO+6H2O①
4NO+6H2O① 2NO+O2==2NO2②
3NO2+H2O==2HNO3+NO③
4NO2+O2+2H2O==4HNO3④
③中的NO可以进入②中继续利用
制取的50%的硝酸用硝酸镁或者浓H2SO4做吸水剂,蒸馏,可得到高浓度的硝酸,甚至98%以上的“发烟”硝酸。尾气处理,生产过程中NO循环使用,可以最大程度利用原料,并且减少尾气中的NOx的排放,尾气一般用NaOH溶液进行吸收,发生氧化还原反应,可以综合利用尾气中的NOx:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO3+H2O
(2)制取的50%的硝酸用硝酸镁或者浓H2SO4做吸水剂,蒸馏,可得到高浓度的硝酸,甚至98%以上的“发烟”硝酸。尾气处理,生产过程中NO循环使用,可以最大程度利用原料,并且减少尾气中的NOx的排放,尾气一般用NaOH溶液进行吸收,发生氧化还原反应,可以综合利用尾气中的NOx 2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH=2NaNO3+H2O
与“(三选一)【化学与技术】工业上制取硝酸铵的流程图如下,请...”考查相似的试题有:
- 下图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质而I是红棕色的气态氧化物。固...
- A、B、C、D为四种短周期元素,A原子核外仅有1个电子,B、C元素的最高价依次+4、+5,D元素常显-2价,已知B、C、D的原子次外层...
- 下列现象或事实可用同一化学原理来解释的是[ ]A.氯化铵和碘都可以用加热法进行提纯B.氯水和二氧化硫气体均能使品红溶液退色...
- 下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单...
- 下列说法不正确的是[ ]A.凡是铵盐都能与苛性钠共热产生NH3B.NH4HCO3受热分解产生的气体经足量碱石灰干燥后可得到纯净的氨气...
- (1)工业上用氨和二氧化碳反应合成尿素。已知下列物质在一定条件下均能与水反应产生。H2是合成氨的原料,供合成尿素用。若从...
- 下列有关生活生产中的叙述合理的是[ ]A.硫酸工业中SO2转化为SO3时采用常压,是因为增大压强不会提高SO2的转化率。B.打开啤...
- 下列描述中,不符合生产实际的是( )A.合成氨工业中,N2和H2的最佳配比应为物质的量之比1:3B.电解法精炼粗铜,用纯铜作阴...
- 科学家一直致力于“人工固氮”的方法研究.(1)目前合成氨的技术原理为:(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ/molN2该反应的...
- 合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为N2(g) +3H2(g)2NH3(g)△H0。①T℃时,向1 L密闭容器中充入0....