本试题 “下列反应:①氢氧化钠与硫酸②一氧化碳与氧气③氢氧化钡与氯化铵④金属铜与硝酸银。其中(用序号填空):(1)属于放热反应的是________;(2)属于吸热反应的是_...” 主要考查您对吸热反应、放热反应
原电池原理
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 吸热反应、放热反应
- 原电池原理
吸热反应:
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:
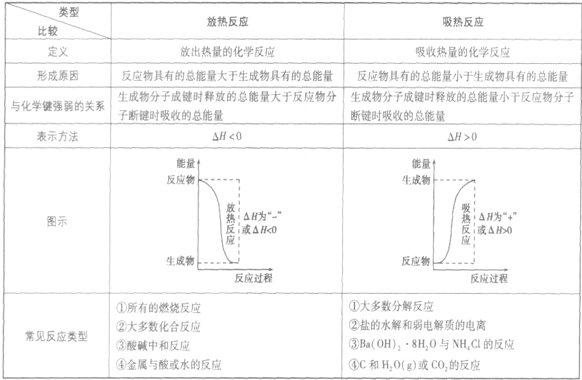
吸收热量的反应,即生成物的总能量大于反应物的总能量,反应需要吸收能量
放热反应:
放出热量的反应,即生成物的总能量小于反应物的总能量,反应释放出能量
放热反应和吸热反应的比较:

原电池:
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例
(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
1.定义:将化学能转化为电能的装置。
2.工作原理:
以铜-锌原电池为例

(1)装置图:

(2)原理图:

3.实质:化学能转化为电能。
4.构成前提:能自发地发生氧化还原反应。
5.电极反应:
负极:失去电子;氧化反应;流出电子
正极:得到电子;氧化反应;流入电子
6.原电池正负极判断的方法:
①由组成原电池的两级材料判断,一般是活泼金属为负极,活泼性较弱的金属或能导电的非金属为正极。
②根据电流方向或电子流动方向判断,电流是由正极流向负极,电子流动方向是由负极流向正极。
③根据原电池里电解质溶液内离子的定向移动方向,在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极。
④根据原电池两级发生的变化来判断,原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
⑤X极增重或减重:X极质量增加,说明溶液中的阳离子在X极(正极)放电,反之,X极质量减少,说明X极金属溶解,X极为负极。
⑥X极有气泡冒出:发生可析出氢气的反应,说明X极为正极。
⑦X极负极pH变化:析氢或吸氧的电极发生反应后,均能使该电极附近电解质溶液的pH增大,X极附近的pH增大,说明X极为正极。
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
发现相似题
与“下列反应:①氢氧化钠与硫酸②一氧化碳与氧气③氢氧化钡与氯化铵...”考查相似的试题有:
- (1)以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池。负极反应式是:______________;正极反应式是:______________(...
- 银锌电池广泛用作各种电子仪器的电源,它的充放电过程可表示为:2Ag+Zn(OH)2Ag2O+Zn+H2O。回答下列问题:(1)该电池属于_...
- 人造地球卫星用到的一种高能电池——银锌蓄电池,它在放电时的电极反应为:Zn + 2OH––2e–=ZnO + H2O,Ag2O + H2O + 2e–=2Ag +...
- 把a、b、c、d四块金属浸泡在稀H2SO4中,用导线两两相连,可组成各种原电池.若把a、b连接时,a为负极;若把c、d连接时,在d上...
- 根据如图提供的信息,下列所得结论正确的是( )A.该反应是吸热反应B.该反应的生成物比反应物稳定C.该反应一定可以设计成...
- (1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生...
- 利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如废铝罐和碳棒,食盐水等材料制作可用于驱...
- 如图装置为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为:2K2S2+KI3K2S4+3KI.装置...
- 研究CO2的利用对促进低碳社会的构建具有重要意义。(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。已知:Fe2O3(s)+3C(石墨)=2F...
- 银锌电池广泛用作于各种电子仪器的电源,它的充电放电过程可表示为2Ag+ Zn(OH)2Ag2O+Zn+H2O, 回答下列有关问题:(1)电池的放...