本试题 “(1)(4分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两...” 主要考查您对化学反应速率的定义、公式
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 化学反应速率的定义、公式
化学反应速率:
1.定义:化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
2.表示方法:在容积不变的反应器中,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。即: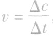
3.单位:mol·L-1·s-1或mol·L-1·min-1等。
4.注意:
(1)化学反应速率是指一段时间内的平均速率,而不是瞬时速率;通常前一段时间的平均反应速率要快于后一段时间的平均反应速率,反应速率均取正值,即v>0。
(2)在一定温度下,固体和纯液体物质单位体积的物质的量保持不变,即物质的量浓度为常数,因此在表示化学反应速率时,不代入固体或纯液体物质的浓度。浓度是指气体或溶液的浓度。
(3)同一个化学反应在相同的条件下、在同一段时间内,用不同物质表示反应速率时,数值可能相同也可能不同,但表达的意义都相同,即反应的快慢程度是一样的。
(4)在同一反应巾用不同的物质来表示反应速率时,其数值之比等于化学方程式中各物质的化学计量数之比.
如化学反应: ,
,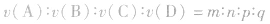 ,所以
,所以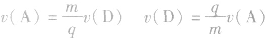
发现相似题
与“(1)(4分)某探究小组用HNO3与大理石反应过程中质量减小的方...”考查相似的试题有:
- 反应4A(g)+6B(g)4C(g)+5D(g)在2L的密闭容器中进行,1min后A气体减少了0.12mol,则平均每秒中浓度变化正确的是A.A气...
- 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g) + B(g) === 2C(g)反应进行到4s末,测得A为0.5mol,B为0.4mol,C为...
- (10分)某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白: (1)实验化学反应原理: 。(2)实验...
- 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程...
- 反应N2(g) + 3H2(g)2NH3(g),如果2min内N2的浓度由6mol/L减小到2mol/L,那么用N2浓度变化来表示的该反应在这2min内的反应速率...
- 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g)反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2m...
- 实验室用Zn与稀H2SO4反应来制取氢气,常加少量CuSO4来加快反应速率。为了研究CuSO4的量对H2生成速率的影响,某同学用实验比较...
- 下列说法正确的是A.0.1 mol·L-1的盐酸和0.1 mol·L-1的醋酸分别与2 mol·L-1的NaOH反应的速率相同B.用锌和稀硫酸反应制取氢气...
- 一定条件下,可逆反应:2A+B3C+4D在下列四种状态下不处于平衡状态的是( ) 正反应速率逆反应速率Av(A)=4mol·l-1·min-1v(B...
- 下图有关于化学反应速率和化学平衡的四个图像,下列反应中全部符合上述图像的反应是A.4NH3(g)+5O2(g)4NO+6H2O(g);△H=-Q1kJ...