本试题 “20℃时,饱和KCl溶液的密度为1.174g/cm3,物质的量浓度为4.0mol/L,则下列说法中不正确的是[ ]A、25℃时,饱和KCl溶液的浓度大于4.0mol/LB、此溶液中KCl的质量...” 主要考查您对物质的量浓度
溶液的质量分数
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 物质的量浓度
- 溶液的质量分数
物质的量浓度:
定义:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度
符号:cB
单位:mol/L(mol·L -1)
计算公式:物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
物质的量浓度与溶液质量分数、密度的关系:c=1000ρω/M
稀释定理:
- 稀释前后溶液中溶质的物质的量不变
c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液) - 稀释前后溶液中溶质的质量不变
ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)
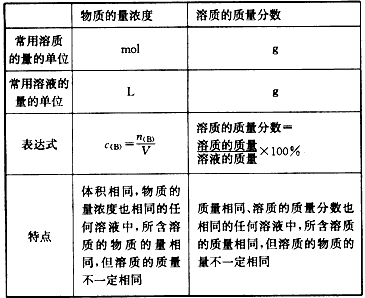
物质的量浓度与质量分数(质量百分比浓度)的比较:
浓度计算的注意事项:
物质的量浓度(cB)=物质的量(n)/溶液的体积(V)
(1)V指溶液体积而不是溶剂的体积;
(2)取出任意体积的1mol/L溶液,其浓度都是1mol/L。但所含溶质的量则因体积不同而不同;
(3)“溶质”是溶液中的溶质,可以是化合物,也可以是离子或气体特定组合,特别的,像NH3、Cl2等物质溶于水后成分复杂,但求算浓度时,仍以溶解前的NH3、Cl2为溶质,如氨水在计算中使用摩尔质量时,用17g/mol。
溶液中溶质的质量分数与溶质的物质的量浓度的换算:
- 溶液中溶质的质量可以用溶质的质量分数表示: m(溶质)=ρ(g·cm-3)·V(L)·w% (1cm3=1mL)
- 溶液中溶质的质量可以用物质的量浓度来表示: m(溶质)=c(mol/L)·V(L)·M(g·mol-1)
- 由于同一溶液中溶质的质量相等,溶液的体积也相等,但注意:1L=1000mL,所以,上述两式可以联系起来:
ρ(g·cm-3)·1000V(mL)·w%=c(mol/L)·V(L)·M(g·mol-1) 化简得:1000ρw%=cM
溶液质量分数= ×100%
×100%
用溶解度表示:
有关溶液的计算:

物质的量浓度与质量分数(质量百分比浓度)的比较:
| 物质的量的浓度 | 溶质的质量分数 | |
| 常用溶质的量的单位 | mol | g |
| 常用溶液的量的单位 | L | g |
| 表达式 | c(B)=n(B)/V | 溶质的质量分数= |
| 特点 | 体积相同,物质的量浓度也相同的任何溶液中,所含溶质的物质的量相同,但溶质的质量不一定相同 | 质量相同,溶质的质量分数相同的任何溶液中,所含溶质的质量相同,但溶质的物质的量不一定相同 |
物质的量浓度与质量分数之间的转化关系:
(1)基本公式: ,c为溶质的物质的量的浓度,单位mol·L-1,ρ为溶液密度,单位为g·cm-3,ω为溶质的质量分数,M为溶质的摩尔质量,单位g·mol-1。
,c为溶质的物质的量的浓度,单位mol·L-1,ρ为溶液密度,单位为g·cm-3,ω为溶质的质量分数,M为溶质的摩尔质量,单位g·mol-1。
(2)公式的推导(按溶液体积为V升推导)
 或
或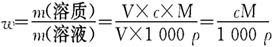
溶质的质量分数:
溶质的质量分数又叫溶液的质量百分比浓度。一般来说,(对大多数溶液)物质的量浓度越大,溶液的密度越大,质量百分比浓度也越大。但是,对于氨水、酒精溶液,物质的量浓度越大,密度越小。
溶液的混合定律:
溶质相同、质量分数分别为a%、b%的两溶液混合:
⑴等体积混合
- 当溶液的密度大于1mol/mL时,必然是溶液浓度越大,密度越大,(如硫酸、硝酸、盐酸、氢氧化钠等多数溶液)等体积混合后,质量分数
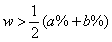 ;
; - 当溶液的密度小于1mol/mL时,必然是溶液浓度越大,密度越小,(如酒精、氨水溶液)等体积混合后,质量分数
 。
。
⑵等质量混合
两溶液等质量混合时,(无论ρ>1g/mL还是ρ<1g/mL),则混合后溶液中溶质的质量分数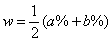
与“20℃时,饱和KCl溶液的密度为1.174g/cm3,物质的量浓度为4.0mo...”考查相似的试题有:
- 100mL1.0mol/L的Na2SO4溶液中,下列关系正确的是[ ]A.C(Na+)=2.0mol/LB.n(Na+)=0.1molC.C(Na+)=2C(SO42-)D.n(Na+...
- 下列溶液中Cl-的物质的量浓度最大的是( )A.50mL0.5mol/LAlCl3溶液B.100mL0.5mol/LMgCl2溶液C.100mL1mol/LNaCl溶液D.50m...
- 将250mLH2SO4的质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到1000mL.(1)此时溶液中H2SO4的物质的量是多少?(2)此时溶液...
- 向20mL2mol/LAlCl3溶液中,加入30mLNaOH溶液,充分反应后,得0.78g沉淀,则NaOH溶液的物质的量浓度为( )A.1mol/LB.2mol/L...
- 在体积为VmL 密度为ρg/cm3的溶液中,含有式量为M的溶质mg,其物质的量浓度为c mol/L,溶质质量分数为ω% 下列表示式中正确的是...
- 甲、乙、丙是三种不含相同离子的可溶性电解质.它们所含离子如下表所示:阳离子NH+4、Na+、Mg2+阴离子OH-、NO-3、SO2-4取等质...
- 用20g烧碱配制成500mL溶液,其物质的量浓度为______mol/L;从中取出1mL,其物质的量浓度为______mol/L;含溶质______g.若将...
- 由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4 mol·L-1, c(SO42-)=0.8 mol·L-1,则c(K+)为[ ]A.0.15 mol...
- 配制500ml 1.0mol/L 稀H2SO4,需要18mol/L 浓H2SO4约多少ml?( )A.500B.100C.28D.18
- 溶质质量分数分别为a%和5a%的H2SO4溶液按等体积混合,混合溶液中H2SO4的质量分数为[ ]A.3a%B.6a%C.﹥3a%D.﹤3a%