本试题 “下列叙述不正确的是[ ]A.CH4O和C2H6O都符合CnH2n+2O的通式,它们可能互为同系物B.16 g CH4与18 g NH4+所含原子核数相等C.32S原子与33S原子的质子数相等,...” 主要考查您对原子核的组成及组成粒子间的关系
分子晶体
核素
同系物
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 原子核的组成及组成粒子间的关系
- 分子晶体
- 核素
- 同系物
构成原子的三种微粒的比较:
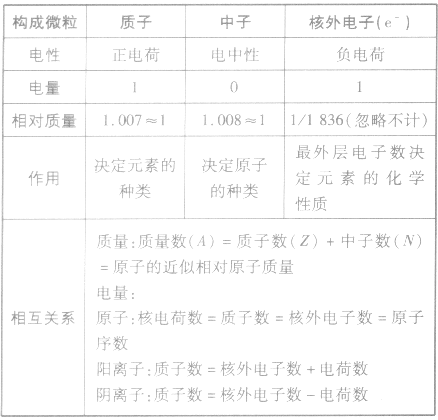
原子的构成:
分子之间通过分子间作用力结合形成的晶体,熔沸点低,导热性、延展性不良,导电性差,硬度较小。如:干冰、固态氖。
晶体的基本类型与性质:

晶体结构模型:
| 晶体 | 晶体结构模型 |
| 氯化铯晶体 |  |
| 氯化钠晶体 | 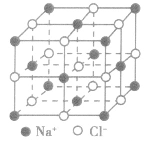 |
| 氟化钙晶体 |  |
| 二氧化碳晶体 | 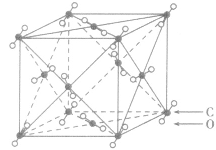 |
| 金刚石晶体 |  |
| SiO2晶体 | 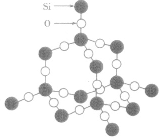 |
| 石墨晶体 (混合晶体) | 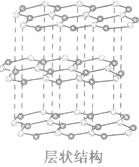 |
晶体中的几个不一定:
(1)由非金属元素构成的晶体不一定为分子品体。如NH4Cl。
(2)具有导电性的晶体不一定是金属晶体。如Si、石墨。
(3)离子晶体不一定只含离子键。如NaOH、 FeS2、Na2O2。
(4)由氢化物构成的晶体不一定是分子晶体。如NaH。
(5)金属与非金属元素构成的晶体不一定是离子晶体。如AlCl3为分子晶体。
(6)原子晶体不一定为绝缘体。如Si。
(7)溶于水能导电的晶体不一定是离子晶体。如HCl。
(8)离子晶体的熔点不一定低于原子晶体。如 MgO的熔点为2852℃,而SiO2的熔点为1710℃。
(9)金属晶体的熔点不一定低于原子晶体。如w 的熔点达34lO℃。
(10)金属晶体的熔点不一定高于分子晶体。如 Hg常温下呈液态,而硫、白磷常温下呈同态.
(11)金属晶体的硬度不一定小于原子晶体。如Cr 的硬度为9,仅次于金刚石。
(12)金属晶体的硬度不一定大于分子晶体。如 Na的硬度只有0.4,可用小刀切割。
(13)晶体巾有阳离子不一定有阴离子。如构成金
定义:
具有一定的质子数和中子数的一种原子叫做核素  的含义:
的含义: 表示一个质量数为A、质子数为Z的原子。
表示一个质量数为A、质子数为Z的原子。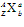 中A表示质量数,Z表示质子数,a表示粒子所带的电荷数和电性,b表示组成该粒子的原子数目。
中A表示质量数,Z表示质子数,a表示粒子所带的电荷数和电性,b表示组成该粒子的原子数目。
元素,核素与同位素的比较:
| 元素 | 同位素 | 核素 | |
| 概念 | 质子数(即核电荷数)相同的一类原子的总称 | 质子数相同而中子数不同的同一元素的不同原子互称为同位素 | 具有一定数目质子和一定数目中子的一种原子 |
| 描述对象 | 宏观物质,列同类原子而言,既有游离态,又有化合态 | 微观物质,对某种元素的原子而言,因为有同位素,所以原子种类多于元素种类 | 微观物质,指某种元素的某种原子 |
| 特征 | 以单质或化合物形式存在,性质通过形成单质或化合物来体现 | 同位素化学性质几乎相同,因为质量数不同,物理性质不同。天然存在的各种同位素所占的原子个数百分比一般不变 | 具有真实的质量,不同核素的质量不相同 |
| 实例 | H、Na、S为不同的三种元素 | 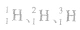 互为同位素 互为同位素 |
 是一种核素, 是一种核素, 是一种核素 是一种核素 |
同系物:
1.概念结构相似,在分子组成上相差一个或若干个CH2 原子团的有机物,互称为同系物。
2.判断同系物的方法
(1)同系物必符合同一通式。
(2)同系物必为同一类物质。如 和
和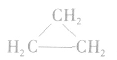 虽都符合通式
虽都符合通式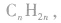 且组成上相差一个CH2原子团,但它们分别属于烯烃和环烷烃,结构不相似,不是同系物。
且组成上相差一个CH2原子团,但它们分别属于烯烃和环烷烃,结构不相似,不是同系物。
(3)同系物化学式不同。
(4)同系物结构相似但不一定完全相同,如 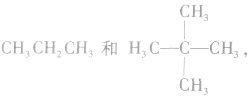 虽前者无支链,而后者有支链,结构不尽相同,但两者碳原子间均以单键结合成链状,结构仍相似,属同系物。
虽前者无支链,而后者有支链,结构不尽相同,但两者碳原子间均以单键结合成链状,结构仍相似,属同系物。
(5)同系物之间的物理性质不同,但化学性质相似。
注意:应用以上方法判断不同物质是否属于同系物时,首先要看两种有机物的结构是否相似、化学性质是否相似,然后再看组成上是否相差一个或若干个CH2原子团,才能快速、准确地作出判断。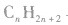 与
与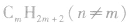 一定是同系物,
一定是同系物,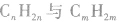 不一定是同系物;
不一定是同系物;
 与
与 与
与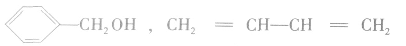 与
与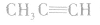 等均不是同系物。
等均不是同系物。
与“下列叙述不正确的是[ ]A.CH4O和C2H6O都符合CnH2n+2O的通式,...”考查相似的试题有:
- (1)0.3 mol NH3分子中所含质子数与________个H2O分子中所含质子数相等。(2)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质...
- 在三种核素中,不相同的是[ ]A.质子数B.中子数C.电子数D.核电荷数
- 基态原子的第5电子层只有2个电子,则该原子的第四电子层中的电子数肯定为[ ]A.8个B.18个C.8~18个D.8~32个
- 某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则Wg的气态氢化物中所含的电子的物质的量为( )A.WA(A...
- 下列叙述错误的是[ ]A.13C和14C属于同一种元素,它们互为同位素B.1H和2H是不同的核素,它们的质子数相等C.14C和14N的质量...
- 在地球上,氦元素主要是以42He的形式存在。下列有关说法正确的是[ ]A、42He原子核内含有4个质子B、32He原子核内含有3个中子C...
- 科学家最近合成第114号元素的原子,该原子的质量数为289,该原子的中子数与电子数之差是( )A.61B.114C.175D.289
- (1)3416S2-微粒中的质子数是______,中子数是______,核外电子数是______.(2)1.5molCO2中含______mol碳原子,______个氧...
- 中国科学技术名词审定委员会公布:111号元素(符号为Rg)的中文名称为 ,以此来纪念科学家伦琴诞辰111周年.第111号元素的某种...
- 下列微粒之间(1)属于同位素的是_______________,(2)属于同素异形体的是_____________,(3)属于同分异构体的是________...