本试题 “下列实验操作错误的是( )A.氧气验满B.收集CO2气体C.读液体体积D.稀释浓硫酸” 主要考查您对测容器—量筒
二氧化碳的制取和收集
浓硫酸的稀释
氧气的检验和验满
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 测容器—量筒
- 二氧化碳的制取和收集
- 浓硫酸的稀释
- 氧气的检验和验满
概念:
量筒是用来量取液体的一种玻璃仪器。量筒是量度液体体积的仪器。规格以所能量度的最大容量(ml)表示,常用的有10ml、25ml、50ml、100ml、250ml、500ml、1000ml等。外壁刻度都是以ml为单位,10ml量简每小格表示0.2ml,而50ml量筒每小格表示1ml。可见量筒越大,管径越粗,其精确度越小,由视线的偏差所造成的读数误差也越大。所以,实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒。分次量取也能引起误差。如量取70ml液体,应选用100ml量筒。
量筒的使用:
(1)怎样把液体注入量筒?
向量筒里注入液体时,应用左手拿住量筒,使量筒略倾斜,右手拿试剂瓶,使量筒量筒瓶口紧挨着量筒口,使液体缓缓流入。待注入的量比所需要的量稍少时,把量筒放平,改用胶头滴管滴加到所需要的量。
(2)量筒的刻度应向哪边?
量筒没有“0”的刻度,一般起始刻度为总容积的1/10。不少化学书上的实验图,量筒的刻度面都背着人,这很不方便。因为视线要透过两层玻璃和液体,若液体是浑浊的,就更看不清刻度,而且刻度数字也不顺眼。所以刻度面对着人才好。
(3)什么时候读出所取液体的体积数?
注入液体后,等1~2分钟,使附着在内壁上的液体流下来,再读出刻度值。否则,读出的数值偏小。
(4)怎样读出所取液体的体积数?
应把量筒放在平整的桌面上,观察刻度时,视线与量筒内液体的凹液面的最低处保持水平,再读出所取液体的体积数。否则,读数会偏高或偏低。
(5)量筒能否加热或量取过热的液体?
量筒面的刻度是指温度在20℃时的体积数。温度升高,量筒发生热膨胀,容积会增大。由此可知,量筒是不能加热的,也不能用于量取过热的液体,更不能在量筒中进行化学反应或配制溶液。
(6)从量筒中倒出液体后是否要用水冲洗量筒?
这要看具体情况而定。如果仅仅是为了使测量准确,没有必要用水冲洗量筒,因为制造量筒时已经考虑到有残留液体这一点。相反,如果冲洗反而使所取体积偏大。如果要用同一量筒再量别的液体,就必须用水冲洗干净,为防止杂质的污染。 注:量筒一般只能用于精度要求不很严格时使用,通常应用于定性分析方面,一般不用于定量分析,因为量筒的误差较大。量筒一般不需估读,因为量筒是粗量器,但有时也需估读,如物理电学量器中的电流表,是否估读尚无定论。
(7)关于量筒仰视与俯视的问题:在看量筒的容积时是看水面的中心点,俯视时视线斜向下视线与筒壁的交点在水面上所以读到的数据偏高,实际量取溶液值偏低,仰视是视线斜向上视线与筒壁的交点在水面下所以读到的数据偏低,实际量取溶液值偏高。
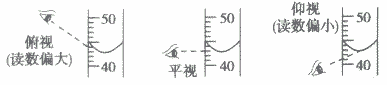
(8)量筒不能直接加热不能在量筒里进行化学反应不能在量筒里配制溶液的原因:
①量筒容积太小,不适宜进行反应
②不能在量筒内稀释或配制溶液,不能对量筒加热,所以不易配制溶液。
③不能在量筒里进行化学反应,以免对量筒产生伤害,有时甚至会发生危险。
④反应可能放热 注意:在量液体时,要根据所量的体积来选择大小恰当的量筒(否则会造成较大的误差),读数时应将量筒垂直平稳放在桌面上,并使量筒的刻度与量筒内的液体凹液面的最低点保持在同一水平面。一般来说量筒是直径越细越好,这样的精确度更高,因为圆形的面积只能计算粗略数,所以直径愈大,误差愈大。
(9)量筒的刻度是从几开始?
最低刻度通常来说是最大刻度的十分之一。比如最大刻度为10mL量筒标准最低刻度1mL,500mL的量筒则最低刻度应为50mL。
解题技巧:
(1)定物量液:是指对某一未知体积的液态物质用量筒量其体积。
例:要量出一杯酒精的体积。方法:
①选择大小合适的量筒。即选用体积略大于一杯酒精灯体积的量筒。
②将烧杯中的酒精倒入量筒中。
③将量筒放平,平视凹液向的最低点,读数即为这杯酒精的体积。若俯视,读数偏高;若仰视,则读数偏低。
(2)定量量液:是指用量筒量取一定体积的某液态物质。例:要量取80mL的水。方法:
①选择100mL的量筒。
②向量筒中倾倒水至接近80mL.刻度线时,改用胶头滴管滴加水至视线在同一水平线上,所量取水的体积即为80mL。若俯视读数,则实际量偏低;若仰视读数,则实际量偏高。
量筒是用来量取液体的一种玻璃仪器。量筒是量度液体体积的仪器。规格以所能量度的最大容量(ml)表示,常用的有10ml、25ml、50ml、100ml、250ml、500ml、1000ml等。外壁刻度都是以ml为单位,10ml量简每小格表示0.2ml,而50ml量筒每小格表示1ml。可见量筒越大,管径越粗,其精确度越小,由视线的偏差所造成的读数误差也越大。所以,实验中应根据所取溶液的体积,尽量选用能一次量取的最小规格的量筒。分次量取也能引起误差。如量取70ml液体,应选用100ml量筒。
量筒的使用:
(1)怎样把液体注入量筒?
向量筒里注入液体时,应用左手拿住量筒,使量筒略倾斜,右手拿试剂瓶,使量筒量筒瓶口紧挨着量筒口,使液体缓缓流入。待注入的量比所需要的量稍少时,把量筒放平,改用胶头滴管滴加到所需要的量。
(2)量筒的刻度应向哪边?
量筒没有“0”的刻度,一般起始刻度为总容积的1/10。不少化学书上的实验图,量筒的刻度面都背着人,这很不方便。因为视线要透过两层玻璃和液体,若液体是浑浊的,就更看不清刻度,而且刻度数字也不顺眼。所以刻度面对着人才好。
(3)什么时候读出所取液体的体积数?
注入液体后,等1~2分钟,使附着在内壁上的液体流下来,再读出刻度值。否则,读出的数值偏小。
(4)怎样读出所取液体的体积数?
应把量筒放在平整的桌面上,观察刻度时,视线与量筒内液体的凹液面的最低处保持水平,再读出所取液体的体积数。否则,读数会偏高或偏低。
(5)量筒能否加热或量取过热的液体?
量筒面的刻度是指温度在20℃时的体积数。温度升高,量筒发生热膨胀,容积会增大。由此可知,量筒是不能加热的,也不能用于量取过热的液体,更不能在量筒中进行化学反应或配制溶液。
(6)从量筒中倒出液体后是否要用水冲洗量筒?
这要看具体情况而定。如果仅仅是为了使测量准确,没有必要用水冲洗量筒,因为制造量筒时已经考虑到有残留液体这一点。相反,如果冲洗反而使所取体积偏大。如果要用同一量筒再量别的液体,就必须用水冲洗干净,为防止杂质的污染。 注:量筒一般只能用于精度要求不很严格时使用,通常应用于定性分析方面,一般不用于定量分析,因为量筒的误差较大。量筒一般不需估读,因为量筒是粗量器,但有时也需估读,如物理电学量器中的电流表,是否估读尚无定论。
(7)关于量筒仰视与俯视的问题:在看量筒的容积时是看水面的中心点,俯视时视线斜向下视线与筒壁的交点在水面上所以读到的数据偏高,实际量取溶液值偏低,仰视是视线斜向上视线与筒壁的交点在水面下所以读到的数据偏低,实际量取溶液值偏高。
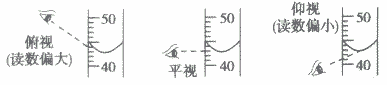
(8)量筒不能直接加热不能在量筒里进行化学反应不能在量筒里配制溶液的原因:
①量筒容积太小,不适宜进行反应
②不能在量筒内稀释或配制溶液,不能对量筒加热,所以不易配制溶液。
③不能在量筒里进行化学反应,以免对量筒产生伤害,有时甚至会发生危险。
④反应可能放热 注意:在量液体时,要根据所量的体积来选择大小恰当的量筒(否则会造成较大的误差),读数时应将量筒垂直平稳放在桌面上,并使量筒的刻度与量筒内的液体凹液面的最低点保持在同一水平面。一般来说量筒是直径越细越好,这样的精确度更高,因为圆形的面积只能计算粗略数,所以直径愈大,误差愈大。
(9)量筒的刻度是从几开始?
最低刻度通常来说是最大刻度的十分之一。比如最大刻度为10mL量筒标准最低刻度1mL,500mL的量筒则最低刻度应为50mL。
解题技巧:
(1)定物量液:是指对某一未知体积的液态物质用量筒量其体积。
例:要量出一杯酒精的体积。方法:
①选择大小合适的量筒。即选用体积略大于一杯酒精灯体积的量筒。
②将烧杯中的酒精倒入量筒中。
③将量筒放平,平视凹液向的最低点,读数即为这杯酒精的体积。若俯视,读数偏高;若仰视,则读数偏低。
(2)定量量液:是指用量筒量取一定体积的某液态物质。例:要量取80mL的水。方法:
①选择100mL的量筒。
②向量筒中倾倒水至接近80mL.刻度线时,改用胶头滴管滴加水至视线在同一水平线上,所量取水的体积即为80mL。若俯视读数,则实际量偏低;若仰视读数,则实际量偏高。
二氧化碳的制取和收集:
1.原理和药品:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.装置:固液混合不加热
(1)发生装置
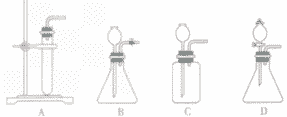
A装置为简易装置,不便于加液体;
B,C使用了长颈漏斗,便于添加液体,使用B、C装置时应注意,长颈漏斗下端管日应伸入液面以下,防止产生的气体从长颈漏斗逸出;
D装置使用了分液漏斗,便于加酸,还可以利用活塞控制反应。
(2)收集装置:二氧化碳溶于水,所以不能用排水法收集;其密度比空气大,所以可采用向上排空气法收集。
如图:
3.现象:块状固体不断溶解,产生大量气泡。
4.检验:把产生的气体通入澄清石灰水,若澄清石灰水变浑浊,证明是二氧化碳。
5.验满:将燃着的木条放在集气瓶口,如果木条的火焰熄灭,证明已集满。
6.实验步骤
a.检查装置的气密性;
b.装入石灰石(或大理石);
c. 塞紧双孔塞;
d.从长颈漏斗中加入稀盐酸;
e.收集气体;
f.验满。
7.注意事项:反应物不能用浓盐酸、硫酸、因为浓盐酸易挥发,会挥发出氯化氢气体,使制得的二氧化碳不纯;硫酸不会挥发,但会生成硫酸钙沉淀,沉淀的硫酸根附着在碳酸钙(或石灰石)表面,使碳酸钙(或石灰石)与酸的接触面积变小,最后反应停止!
实验室制取二氧化碳的选择:
实验室用大理石或石灰石(主要成分是碳酸钙)和稀盐酸制取二氧化碳。
注意:
(1)不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会橙盖在碳酸钙的表面,阻止反应继续进行。
(2)不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
(3)不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。反应速率的快慢与反应物的质量分数和接触面积有关。反应物的接触面积越大,反应物的质量分数越大,反应速率就越快,反之,则越慢。
各组物质反应情况如下表所示:
| 药品 | 反应速率 |
| 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| 石灰石粉末和稀盐酸 | 产生气泡速率很快 |
| 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
浓硫酸:
俗称坏水。坏水指浓度大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,难挥发性,酸性,稳定性,吸水性等。
浓硫酸的稀释:
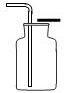
稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中,因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾。使硫酸液滴向四周飞溅,这是非常危险的(如下图)。若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%一5%的 NaHCO3溶液。
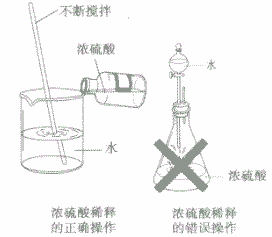
切记“酸入水,沿器壁,慢慢倒,不断搅”。注酸入水不断搅拌
俗称坏水。坏水指浓度大于或等于70%的硫酸溶液。浓硫酸在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。同时它还具有脱水性,强氧化性,难挥发性,酸性,稳定性,吸水性等。
浓硫酸的稀释:
稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中,因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾。使硫酸液滴向四周飞溅,这是非常危险的(如下图)。若不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%一5%的 NaHCO3溶液。

切记“酸入水,沿器壁,慢慢倒,不断搅”。注酸入水不断搅拌
氧气检验和验满方法:
1.检验:用带火星的木条,如果带火星的木条复燃,则证明有氧气存在
2.验满:氧气验满仍是用带火星的木条,但不同的是,此时气体已经确认是氧气,
且带火星部分只能放在瓶口处(这样才能保证氧气已满),若木条立即复燃且燃烧旺盛,
则氧气已满。(因为若氧气未满,也可使木条复燃,只是不会“立即”和“旺盛”)
1.检验:用带火星的木条,如果带火星的木条复燃,则证明有氧气存在
2.验满:氧气验满仍是用带火星的木条,但不同的是,此时气体已经确认是氧气,
且带火星部分只能放在瓶口处(这样才能保证氧气已满),若木条立即复燃且燃烧旺盛,
则氧气已满。(因为若氧气未满,也可使木条复燃,只是不会“立即”和“旺盛”)
发现相似题
与“下列实验操作错误的是( )A.氧气验满B.收集CO2气体C.读液...”考查相似的试题有:
- (3分)实验室里的药品,有的有毒性,有的有腐蚀性,所以,使用药品时,不能 ,不要 ,特别注意不得
- 下列实验操作正确的是A.做燃烧条件探究实验,白磷不可在空气中切取B.粗盐提纯实验中,用手把灼热的蒸发皿拿走C.测溶液的pH...
- 化学实验基本操作在化学学习和研究中具有重要作用。我们在进入化学实验时,若遇到下列情况,应如何操作。(1)不慎碰翻酒精灯,...
- (3分)规范的实验操作是实验成功的前提,请回答:(1)量取8mL稀硫酸,应选用______________mL的量筒。(2)胶头滴管用过后...
- 根据下图所示装置回答下列问题。(1)仪器①、②的名称:① ② 。(2)在组装A装置时,应根据_________________的位置调节试管的...
- 现有如下仪器:(1)若要用仪器A连接一套用双氧水制取和收集氧气的装置,最少还需要选用的仪器是______(填序号),至少还缺...
- 制取CO2药品:______和______.原理:______.验满CO2:将______的木条放在______口,若木条______,则满.检验CO2:将气体通...
- 某实验小组用下图所示装置制备常见气体。请回答下列问题:(1)写出图中标号a的仪器名称: 。(2)实验小组制取的一种常见气...
- 实验室部分仪器或装置如图所示,请回答下列问题(1)仪器①的名称是________,写出该仪器在使用时的一条注意事项 ;(2)若用...
- 小丽和几位同学在实验室用下列装置制取几种气体.(1)出图中有标号的仪器的名称:①______; ②______.(2)若用高锰酸钾制取...