本试题 “已知反应:①Cl2+2KBr==2KCl+Br2,②KClO3+6HCl(浓)==3Cl2↑+KCl +3H2O,③2KBrO3+Cl2==Br2+2KClO3,下列说法正确的是[ ]A.上述三个反应都有单质生成,所以都...” 主要考查您对氧化性、还原性强弱的比较
置换反应
氧化还原反应的计算
等考点的理解。关于这些考点您可以点击下面的选项卡查看详细档案。
- 氧化性、还原性强弱的比较
- 置换反应
- 氧化还原反应的计算
置换反应:
单质与化合物反应生成另外的单质和化合物的化学反应
发生置换反应的原理:
必须是活动性强的金属置换活动性弱的金属或H+溶液
根据元素性质分类:
1.金属单质置换金属单质:2Al+Fe2O3=高温=Al2O3+2Fe(铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换);Fe+CuSO4=FeSO4+Cu
2.金属单质置换非金属单质:Zn+2HCl=H2↑+ZnCl2 ;2Na+2H2O=2NaOH+H2↑;2Mg+CO2=点燃=2MgO+C;3Fe+4H2O(g)=高温=Fe3O4+4H2
3.非金属单质置换金属单质:H2+CuO=Δ=Cu+H2O ;C+FeO=Δ=Fe+CO↑
4.非金属单质置换非金属单质:2F2+2H2O=4HF+O2 ;2C+SiO2=Si+2CO↑ ;C+H2O=高温=CO+H2 ;2H2+SiCl4=Si+4HCl ;Cl2+2NaBr=Br2+2NaCl
置换反应与氧化还原反应的关系:
置换反应一定属于氧化还原反应。
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如

5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:
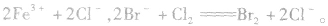 。
。
与“已知反应:①Cl2+2KBr==2KCl+Br2,②KClO3+6HCl(浓)==3Cl2↑+K...”考查相似的试题有:
- 下列实验均发生了化学反应:①将铁钉放入CuSO4溶液中;②向FeSO4溶液中滴加浓HNO3;③将铜丝放入FeCl3溶液中。下列判断中,正确...
- (1)在反应2KMnO4+16HBr(浓)=5Br2+2MnBr2+2KBr+8H2O 中,还原剂是_______________。(2)已知BrFx与H2O按物质的量之比3:5反应...
- 已知下列两个反应:①Cl2+2KI=I2+2KCl ②I2+2KClO3=Cl2+2KIO3.下列说法中不正确的是( )A.①②均属于置换反应B.①中的I2是氧化...
- 已知反应2X-+Z2=2Z-+X2,2W-+X2=2X-+W2能从左向右进行,则反应:W2+2Z-=Z2+2W-进行的方向是( )A.从左向右B.从右向左C.不...
- 制备硅单质时,主要化学反应如下:(1)SiO2+ 2CSi+2CO↑(石英沙) (焦炭) (粗硅)(2)Si(粗)+2Cl2SiCl4(3)SiCl4+2H2Si(纯)+4HCl对...
- 在一种酸性溶液中,可能存在NO -3、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正...
- 对于有反应3Cl2+6KOH(浓、热)═5KCl+KClO3+3H2O,以下叙述正确的是( )A.KClO3是还原产物,具有还原性B.氧化剂与还原剂物...
- 时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化...
- 一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3:5,则参加反应的Cl2与NaOH物质的量之比为( ...
- 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X...